全球人口老龄化,导致与年龄相关的神经退行性疾病的负担日益加重。对老年痴呆患者进行干预通常被证明是无效的。这些失败表明,一旦广泛的恶化发生,终生的大脑老化可能很难逆转。因此我们需要大脑老化的生物标记来指示大脑加速退化的细微迹象。
为此,来自杜克大学心理和神经科学系的Maxwell L. Elliott在Ageing Research Reviews杂志发文,回顾了一些潜在的基于MRI的生物标记物,这些生物标记可以将中年大脑衰老与老年痴呆症联系起来。查阅文献时作者考虑了三个问题:
l 生物标志指数是否随着年龄变化?
l 生物标志物能否检测出认知能力下降?
l 生物标志物对已知的痴呆危险因素是否敏感?
作者发现,虽然一些基于MRI的生物标志物有初步的支持,但能最好回答这些问题的纵向研究仍处于起步阶段,需要进一步发展。
1. 引言
全球人口正在老龄化,预计到2050年,60岁以上的人口数量将增加两倍以上。在发达国家,这种广泛的人口结构转变将更为极端。这些人口结构的变化反映了过去两个世纪现代医学的进步,以及在治疗传染病、减少分娩风险、延长寿命和广泛增加粮食产量方面取得的进展。人口老龄化是这种进步的表现,同时也是即将到来的公共卫生挑战的预警。
尽管医学取得了进步,但在过去20年里,由于人口老龄化和与年龄有关疾病的稳定发病率,全球负担有所增加。许多器官系统会受衰老的影响,而大脑的退化是年龄相关疾病的一种特别衰老形式。认知能力下降是大脑老化的一个潜在后果,它与执行日常任务、保持独立性和照顾自己的能力下降密切相关。认知能力下降是痴呆一类疾病的一个标志。痴呆是一种涵盖了一系列具有异质性病因的疾病的综合诊断。虽然在某些类型的痴呆症中,认知能力下降可能是由一些孤立的因素引起的,如传染性疾病、急性创伤性脑损伤和罕见的遗传疾病,但衰老研究通常集中在被归类为“老年神经认知障碍”的痴呆症轨迹上。这类与年龄有关的痴呆症包括阿尔茨海默、额颞叶痴呆和血管性痴呆。 与老年痴呆症相关的研究通常选择老年人作为被试。年龄确实是痴呆症的最大风险因素。然而,针对老年人的干预措施已在很大程度上被证明在限制发病率和残疾方面是无效的。这些失败被假设为多年不可逆的亚临床器官衰退的结果。如果这是真的,那么干预措施可能无法减缓与年龄相关的疾病,因为它们在衰老过程中实施得太晚,而衰老已经站稳脚跟。
在新一代的老年科学模型中,衰老不再被看作是生命中一个孤立的阶段,而是被看作是一个终生的过程,其结果是器官系统在整个生命周期中逐渐受到损害。临床上可检测到的与年龄有关的痴呆和认知障碍代表了一个终生老化过程的结束,在这个过程中,遗传易感性、环境损伤和生活方式因素相互作用,形成痴呆的病因学。与这一观点相一致的是,许多痴呆的危险因素在儿童和中年人中是可以测量的,在某些情况下,像血压这样的危险因素在中年时测量比在老年时更能预测后期痴呆的危险。因此,早在中年阶段就需要对目标个体进行干预,在器官衰弱前就进行巩固以减缓衰老过程。
虽然将痴呆症预防研究从老年人转向中年人是一种有希望延长健康寿命的方法,但它也带来了方法上的两难。在典型的痴呆症预防试验中,一组六七十岁的老年痴呆症高危人群接受了干预。然后对这一组进行数年的跟踪,对他们的认知能力下降和痴呆患病率进行量化,并与未接受干预的对照组进行比较。在这些试验中,测量结果(痴呆症患病率和认知能力下降)和预防目标是相同的。虽然在方法上是合理的,但是这种类型的干预设计将很难推广到针对中年个体的干预中。例如,如果对40多岁的人而不是60多岁的人实施抗痴呆干预,那么临床试验将必须额外持续20年,以便将痴呆症的发作作为结果衡量标准,因为与年龄有关的痴呆症在65岁之前发作是不常见的。在典型的干预试验基础上增加20年的随访将大大增加这些研究的财政负担,并严重限制可资助的试验数量。
一种解决方案是寻找生物标记,这些标记反映了生物学和认知方面的亚临床变化,这些亚临床变化指示了发病前痴呆。这种生物标记方法已经在量化中年年龄个体差异方面取得成功。一项针对38岁人群的代表性研究发现,衰老相关指标的多层生物标志物与认知能力下降、健康状况恶化和面部衰老加速有关。此外,在一项随机对照试验中发现,限制热量摄入可以延缓生物衰老。然而,尽管这些多层老化生物标记物在许多针对中年的干预试验中有效,但它们可能不是与老化相关的痴呆症研究的理想生物标记物,因为它们不能直接测量大脑的退化,而大脑是一个直接负责认知、记忆和智力功能的器官。在寻找加速的中年老化的敏感生物标记物的过程中,重要的是测量要保持接近假定的神经变化的病因学途径,这一途径将中年老化与老年痴呆联系起来。
大脑病理学的细微变化可能在整个成年期都可以检测到,而准确地量化这些变化在中年期可能会揭示对痴呆风险的进一步了解。因此下文将包括以下几个部分:
l 概述年龄相关的认知变化及其与痴呆的关系和对MRI生物标记物的意义(第二节);
l 根据已有研究,寻找最有可能提示中年加速衰老和痴呆风险的MRI生物标记物(第三节);
l 总结相关研究,为未来的老龄化研究和痴呆干预提供方向(第四节)。
在第三节中,又会分成灰质、白质两小节进行阐述,原因如下:
1、发育/衰老相关研究主要关注结构像;
2、相比于功能像,结构像的结果更可靠;
3、结构像更接近神经退行性变化与认知能力下降之间的假定因果通路;
4、虽然PET被广泛用于量化老年阿尔茨海默的患病风险,但它是一种需要暴露在辐射下的侵入性测量方法,因此在成年早期和中年没有得到广泛的研究。
2. 认知老化和痴呆
为了解中年大脑加速老化和痴呆风险的生物标记是什么样子,首先需要了解认知老化在整个生命周期中是什么样子,以及认知老化如何与老年人痴呆的诊断相关。一个基于MRI的中年生物标志物要想在痴呆症风险分层和推进老年痴呆症的治疗中发挥作用,它必须首先追踪中年认知和认知衰退与老年痴呆症之间的关系。从认知老化和痴呆的研究中我们可以得到一些经验教训,这些经验教训将为寻找加速老化和痴呆风险的MRI生物标记提供信息。
在整个生命周期中,认知能力在儿童时期呈现快速发展的一般模式,然后在青春期趋于稳定,在整个成年期呈下降趋势。虽然很多认知能力的衰退,如推理、知觉速度和情景记忆在20岁早期就开始了,但这一轨迹并不适用于所有的认知领域。例如,一个人的词汇量在成年期的大部分时间里持续增长(r=0.63),在55岁左右达到顶峰,然后开始下降。虽然这些认知老化的一般趋势已得到充分的证明,但在解释与年龄相关的认知衰退、认知能力峰值、痴呆风险因素和痴呆诊断之间的关系时仍存在一些困难。
解释痴呆风险因素的另一个挑战是目前诊断痴呆方法的固有局限性。要符合DSM-V痴呆诊断标准,患者必须有严重的认知障碍,干扰日常生活活动。这种损害一定是较高水平功能下降的结果,这种下降必须超过正常老化的预期(美国精神病学协会,2013年)。虽然这些标准在概念上很清楚,但在实际应用时却存在一些限制。我们先来看看认知障碍的标准。认知障碍的测量通常采用简短的神经心理学评估(如简易精神状态检查(MMSE))。这些短期评估通过使用一个确定痴呆状态的数值阈值,来区分正常认知功能的人和有认知障碍的人。虽然这种方法可能对测量当前的认知障碍有用,但单独使用时,单一MMSE评分无法区分认知功能高/低个体 (见图2)。虽然临床医生和研究人员试图通过评估“以前的高级功能水平下降”来克服这一限制,但很少有严格的、纵向的认知功能测量,通常是通过自我报告和/或家庭成员的报告来评估认知功能下降。不幸的是,人类的记忆和自我报告是有限的,并可能导致不完善的评估程度和认知下降的速度。
这些实际的限制可能会导致那些认知功能基线水平较低的人过度诊断痴呆。这些诊断上的局限性导致一些研究人员呼吁对痴呆症进行基于变化的评估,以便神经心理学评估能够更准确地识别出认知能力下降超过“正常老化”的个体。MRI生物标志物是评估大脑加速衰老的有效指标,它应该是大脑完整性加速下降的一个标志,这是不被成年早期的整体认知功能水平所混淆的。在这篇文章中,作者将利用横向和纵向研究的结果来评估目前的MRI生物标记物在多大程度上符合这一理想目标。
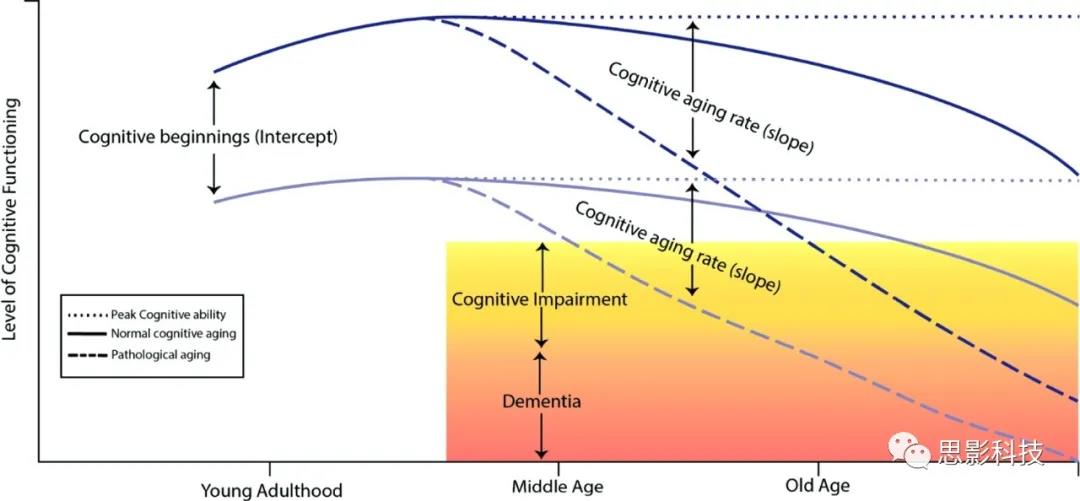
图2 一生中认知功能发展的假设轨迹
3. 衰老大脑的MRI生物标记候选
对于这里考虑的每一项MRI测量,作者将回顾最近的文献,以确定每一项作为测量加速脑老化和中年痴呆风险分层的生物标志物的潜力。具体来说,在讨论每种模式时,将考虑基于MRI的中年大脑老化和痴呆风险的生物标志物的三个互补特征:
首先,研究生命周期中的变化。要完全理解加速衰老的样子,我们必须首先确定与年龄有关的正常变化模式。对中年加速老化敏感的生物标记应该首先显示生物学上有意义的年龄相关变异。
其次,回顾提出的MRI生物标志物与整个生命周期认知之间的关系。这里将回顾认知能力和认知能力下降之间的关系,因为它们代表了痴呆症风险的可分离特征。正如上文所述(见第2节),理想的MRI生物标志应该是认知能力下降的指标。
最后,生物标志应该与已知的中年痴呆危险因素,比如高血压、肥胖、糖尿病等存在相关。如果老化确实是一个终生的过程,那么危险因素和基于MRI的生物标志物之间的联系可能在临床诊断的痴呆症发作之前就能被检测出来。
3.1 灰质测量
最常见的测量灰质的MRI方法是VBM(voxel based morphometry),它是一种测量灰质局部密度的方法。虽然VBM被广泛用于量化年龄相关的灰质变化以及年龄相关病理的组间差异,但SBM(译者注:此处原文为VBM,但结合引文译者认为应为surface-based morphology,SBM))由两个不同的组成部分组成:皮层厚度和曲面面积(cortical thickness and surface area)。皮层厚度和曲面面积已被证明是遗传和表型独立的,这就对通过体积指标(如VBM)而不是分别测量曲面面积和皮层厚度是否合理提出了质疑。这些测量方法的区别在年龄相关变化的研究中可能特别重要,因为皮质厚度和曲面面积已被证明有独立的发育轨迹。此外,灰质体积的个体差异与皮层厚度/曲面面积的个体差异在很大程度上是重叠的。横断灰质体积与受试者的曲面积高度相关(r > 0.8),与皮层厚度仅微弱相关。另外,与年龄相关的灰质体积纵向下降主要是由皮层变薄(r >0.9)和曲面面积的微弱变化导致的。因此,在这篇关于中年老化的候选生物标志物的综述中,重点放在报告皮质厚度(图1A)和曲面面积(图1B)的研究上。
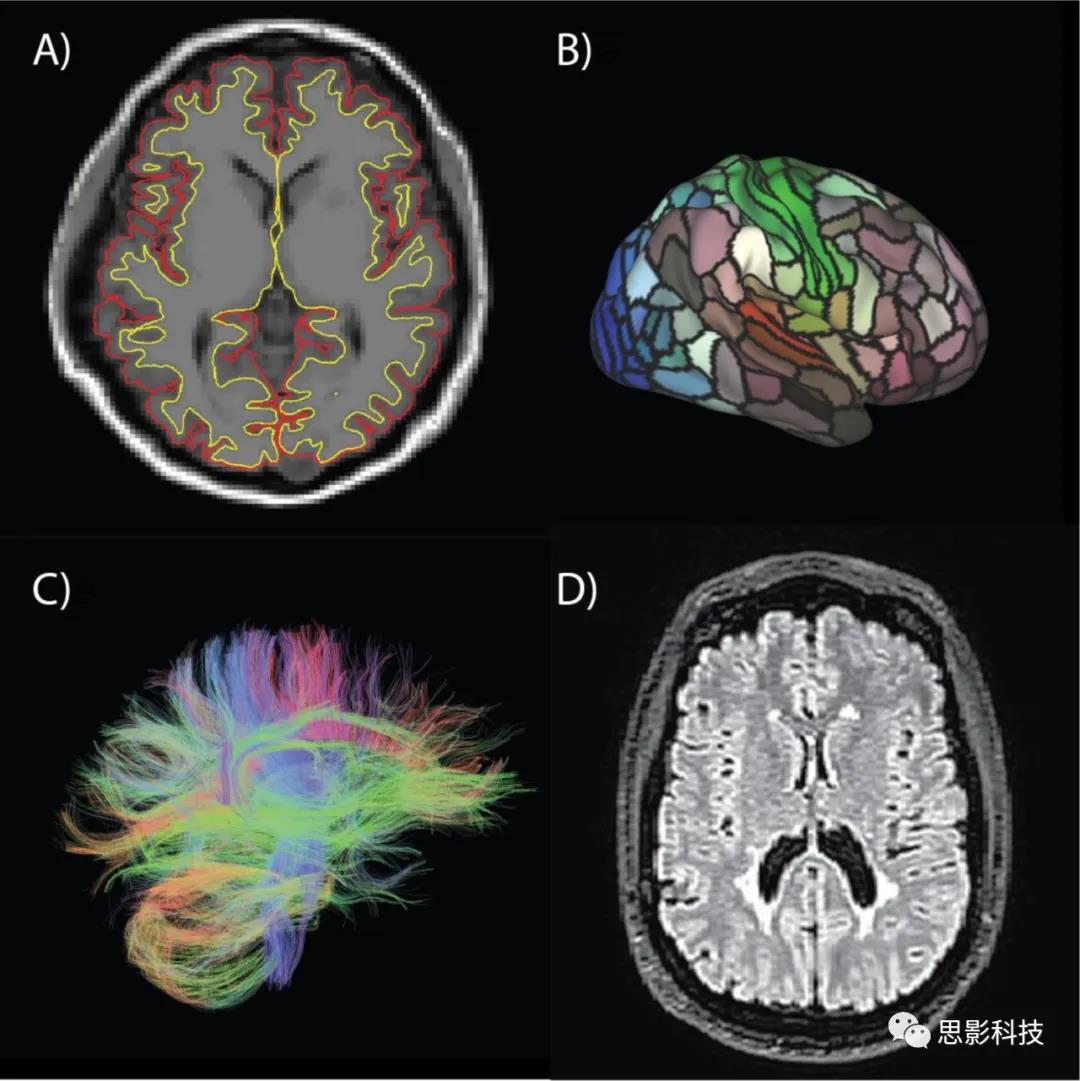 图1 MRI生物标记物可视化。A为皮层厚度,B为曲面面积,C为DTI白质纤维追踪,D为FLAIR成像。
图1 MRI生物标记物可视化。A为皮层厚度,B为曲面面积,C为DTI白质纤维追踪,D为FLAIR成像。
3.1.1 人生全程变化
大量研究表明,灰质的变化是贯穿人类一生的。虽然关于大脑皮层厚度在2岁左右或更晚的儿童时期达到峰值存在一些分歧,但大量的横断面研究提供了证据,表明在人类绝大多数的发育过程中,皮质都在变薄。这种普遍的模式似乎也表现在曲面面积上 (见图3)。虽然皮层厚度在幼儿时期达到顶峰,但在整个青春期,曲面面积仍在继续增长,在2岁以后,皮层体积的增长主要是由皮层面积增长引起的。然而,在20岁左右,曲面面积不再扩大,并一直下降直到老年。
虽然大脑皮层厚度和曲面面积在20岁以后都呈现出下降的模式,但下降的速度是不同的,在整个生命周期中呈非线性,大脑各区域之间也不均匀。大量的横断面成像研究表明,年龄与整个生命周期的皮质厚度呈非线性关系。横向研究和纵向研究都发现,非线性表现为14岁之前和60岁之后,皮层厚度每年明显下降近1%。在中年时期,皮层厚度每年下降0.1%-0.5%,呈线性且稳定的下降趋势。跟踪研究对象1-7年的纵向数据表明,曲面面积下降的模式似乎与20岁以后每年约4%的平均下降率更加一致。然而,持续的灰质下降并不是大脑的普遍现象。内嗅皮层是记忆形成的关键区域,也是与年龄有关的记忆能力变化的中心,它似乎是这一规律的一个显著例外。一项大型横断面研究(N = 1660)显示,与20岁以后大脑皮层厚度持续下降的模式相反,内嗅皮层厚度在44岁时达到峰值,之后才开始下降。
总体而言,区域衰退模式似乎是非随机的,遵循发展和进化趋势。多项研究表明,额叶和顶叶皮层区域是发育最慢、衰退最快的区域之一。这些区域具有最复杂的皮层结构,绝大多数支持高阶认知过程,并且是跨模态的,位于感觉处理层次的顶端,在那里它们绑定来自单模态区域的信息。这些观察结果被合成为灰质皮质发育的“后进先出”理论。这一理论表明,支持人类认知中最复杂方面的区域需要最长的时间来发展,同时也是受衰老影响最早、最严重的区域。这些额叶和顶叶的大脑区域在进化过程中也显示出最大的皮质扩张,同时也是最复杂的突触和树突。
3.1.2 认知共变和认知衰退
从儿童时期开始,皮层厚度和曲面面积都与认知能力的个体差异有关。皮质较薄的儿童在记忆、视觉空间功能、空间推理和问题解决等测试中表现更好。然而,大脑皮层较薄与认知能力之间的关系在人的一生中并不稳定。对不同年龄的个体进行了3-5年的纵向分析表明,在成年期,这种模式发生了逆转,具有较高认知能力的个体倾向于拥有更厚的皮质,保持皮质厚度成为维持认知能力的重要因素。与皮层厚度相比,更大的曲面面积与更高的认知能力在整个生命周期中稳定相关。
纵向测量显示,从成年到老年,认知能力高/低个体的曲面面积呈平行下降轨迹。虽然一些将灰质发育与认知能力联系起来的研究有纵向MRI数据和大样本,但几乎所有的研究都缺乏可用于控制发病前认知能力和测量同一个体认知能力变化的认知功能重复测量。认知的纵向测量是很重要的,因为它使研究人员能够将认知能力的峰值与认知能力下降的速度分离开来。有一个独特的样本(Lothian Birth Cohort),分别测量同一个体在11岁和73岁的认知能力。研究人员利用这个样本发现,60年来认知能力的下降与整个大脑的曲面面积缩小有关,但似乎与皮层厚度无关。值得注意的是,许多显示出与认知能力下降关联最大的区域都是相同的额叶和顶叶区域,在这些区域的表面区域显示出最新的发育成熟,与认知能力的关联最强。这些研究中曲面面积的特异性也与一项大型双胞胎研究一致,该研究表明,认知能力在表型和遗传上与曲面面积有关,而与皮层厚度无关。此外,通过Lothian Birth Cohort,研究人员还发现,晚年(74-77岁)认知能力的下降与灰质体积的纵向萎缩密切相关。
3.1.3与痴呆风险因素的关联
许多可改变的痴呆危险因素与大脑无关。最近一篇有影响力的文献综述发现,以下表型可作为认知功能下降和痴呆的可改变危险因素:创伤性脑损伤、中年肥胖、中年高血压、吸烟和糖尿病。重要的是,这些风险因素都可以在一个人的一生中进行评估,预测以后的痴呆风险,并且是中年干预的可调整目标。因此,如果脑灰质的MRI测量是痴呆风险的生物标志物,它们也应该对暴露于这些可改变的危险因素敏感,如果危险因素减轻,它们可能是可逆的。
重要的是要注意痴呆的可改变危险因素并不都是独立的。一组相关的风险表型被标记为“血管风险”,由缺乏运动、饮食不良、肥胖、高血压、吸烟和糖尿病组成。在观察性研究中,血管风险与灰质减少广泛相关。此外,老年人高血压与整体皮层厚度下降有关,这是由额叶、顶叶和颞叶皮质变薄引起的。高血压与广泛的大脑变薄模式以及脑容量减少之间的这种联系已被其他研究证实,并已被证明部分独立于胆固醇和淀粉样蛋白。此外,最近在英国生物银行((UK Biobank))进行的一项大型研究发现,多种血管风险因素(包括糖尿病、高血压、体重指数和腰臀比)和较低的灰质体积之间存在关联,在额叶和颞叶区域的影响最大。然而,在大多数研究中,这些影响仅限于测量老年人在同一时间点的高血压和皮层厚度。在一项对高血压进行纵向评估的研究中,发现老年时类似的皮质变薄模式(这一次是在脑岛、额叶和颞叶皮质)与中年高血压有关。总之,这些结果表明,贯穿一生的高血压与皮质变薄有关。
一般来说,这种皮质变薄和萎缩的加速模式存在于几种痴呆危险因素中。皮质变薄已经在肥胖、体重指数、糖尿病、吸烟和创伤性脑损伤的研究中发现。与这些发现相辅相成是,皮质保留与更高水平的身体活动、认知训练以及对地中海式饮食的更多坚持有关。再一次,这种细化被发现在支持高阶认知的额叶、颞叶和顶叶区域最为突出,这些区域也最容易发生与痴呆和认知能力下降相关的神经退行性变。此外,虽然几项大型横向研究未能发现APOE基因风险与脑容量或皮质厚度的关系,但是纵向研究发现更高的痴呆APOE风险与中年时检测到的皮层体积减少加快和海马变薄有关。
鉴于这些研究大多是横断面的,必须谨慎解释。理清潜在因果方向的相对贡献是很重要的,因为通常不清楚是健康的大脑选择了健康的行为还是健康的行为驱动了健康大脑的选择。例如,皮质较薄的人可能认知能力较低,做出不健康的选择导致患高血压的比例更高,而不是高血压导致皮层厚度减少。因此需要进行更多的纵向研究,将痴呆症风险因素的变化与大脑灰质的变化联系起来,以确定因果影响对这些横断面关联的相对贡献。此外,针对痴呆危险因素的干预措施需要进行纵向测量,以最好地确定痴呆危险因素、皮层厚度和曲面面积之间的因果关系。
综上所述,皮层厚度和曲面面积都部分实现了中年痴呆风险的3个特征:
首先,在整个发育和衰老过程中,曲面面积和皮层厚度表现出一致的变化模式。大脑皮层的衰退模式是不均匀的,有证据表明,在进化过程中,支持高级认知功能的大脑皮层区域可能最容易受到与年龄相关的神经退化的影响。
其次,横断面数据表明,在人的后半生,较厚的皮层和较大的曲面面积都与认知能力有关。
第三,有迹象表明,曲面面积和皮层厚度与痴呆风险因素有关。虽然这些一般趋势在文献中是明确的,但目前关于大脑老化的绝大多数证据来自横断面数据。横断面研究表明,年龄与皮质变薄或曲面面积减少之间存在联系,但其推断人的变化的能力最终受到限制。未来对认知能力、痴呆风险因素和灰质完整性进行多项测量的纵向研究,对于理解认知开始、认知衰退和大脑衰老之间的相互作用至关重要。
3.2 白质测量
自20世纪80年代后期以来,鉴别白质老化变化最常用的MRI方法之一是 FLAIR成像(fluid attenuated inversion recovery)。FLAIR成像可以检测脑白质高信号(图2D),表明脑白质中水分含量和水分流动性的相对增加。这些含水量的变化已被证明是由组织损伤的异质性阵列引起的,包括脑微出血、中风、脑出血、脱髓鞘和轴突丢失。 随着MRI技术的发展,弥散张量成像(diffusion tensor imaging, DTI)已成为FLAIR成像的一种补充技术。DTI能够测量更细微的白质降解变化,对白质完整性的个体差异以及以白质高信号为代表的病理降解很敏感。用于测量年龄相关变化的最常见的DTI指标是分数各向异性(FA)和平均扩散率(MD)。FA测量水分子的定向扩散,范围从0到1,数值越大,说明扩散的方向性越强(图2C)。没有约束,水分子会均匀地向各个方向扩散,导致FA较低。因此,当水在白质中的扩散受到轴突束、较高的髓磷脂含量和均匀的纤维排列的约束时,FA值较高。MD测量水在各个方向的平均扩散。因此,MD值越低,说明水分扩散越少,组织约束越多,这是健康大脑的特征。因此,FA和MD是互补的、负相关的测量方法,它们对轴突完整性、间质流体流动性和含水量的变化敏感,并预测白质组织向白质高信号的转化。值得注意的是,DTI测量也有几个局限性,在解释与衰老表型的关联时需要考虑这些局限性,包括运动引起的潜在混淆、扩散差异的多种因素(如髓鞘形成、轴突密度和膜透性)和对数据质量的高敏感性。在下一节中,将重点介绍白质高信号、FA和MD的生物标志物潜力。
3.2.1 人生全程变化
白质高信号通常在中年或更晚的被试中测量,因为30岁之前是不常见的。然而,超过90%的人在65岁以后出现白质高信号。一项可靠的研究发现,白质高信号的总体积与年龄呈正相关。这种联系是对数线性的,表明随着人们年龄的增长,他们倾向于以更快的速度积累白质高信号(图3)。对数千人进行的大型横断面研究表明,年龄解释了白质高信号容量中近25%的差异。此外,纵向研究发现,随着个体年龄的增长,白质高信号的积累并不是随机发生的,而是反映了先前高强度的扩展。
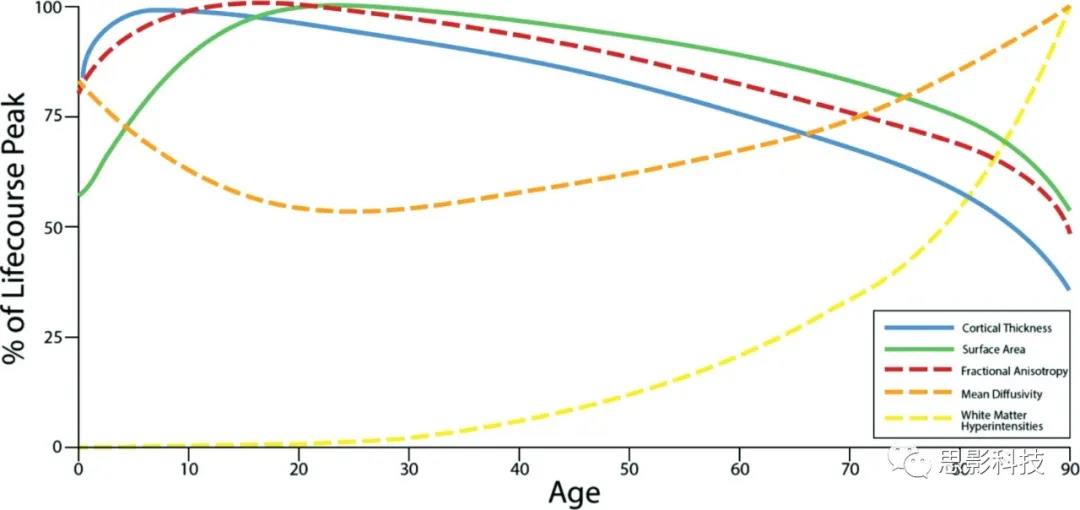
图3 随着年龄的变化,各MRI生物标志物的变化
在FA和MD中发现了与年龄的互补关系。
横向研究和纵向研究都表明,从出生到成年早期,FA每年增加5-7%,MD每年减少5-7%。这种模式与持续的髓鞘形成和轴突密度的增加是一致的,而轴突密度的增加是人类大脑发育相对延长的部分原因。在白质发育的这种模式中存在着tract-specific异质性。具体来说,负责信息整合和复杂认知任务的连接额叶脑区的白质束表现为成熟迟缓,而支持基本感觉处理的白质束则是成熟最快的。然而,一般来说,白质关联的区域特异性比灰质关联的结果要少得多。
儿童期以后,横向研究和纵向研究都发现,随着年龄的增长,全脑FA的减少和MD的增加之间有很强的联系。在20 - 40岁之间,白质束中FA和MD的发展趋于稳定,并开始出现衰老的最初迹象。40岁以后,白质的退化几乎是普遍的,而且随着年龄的增长,白质退化的速度也加快了。40岁时,脑白质完整性平均每年下降不到1%,但到80岁时加速下降到每年近3%。
在老年时,DTI测量值与白质高信号密切相关,是白质降解的互补元素。白质高信号区及附近区域的FA较低,MD较高。此外,FA、MD和白质高信号本身预测了额外白质高信号的出现和扩散。虽然白质细微变化与后来白质疾病之间的这种耦合已经在老年人中广泛地显示出来,但年轻个体中这种耦合还有待深入研究。总的来说,白质高信号、FA和MD表现出贯穿生命周期的变化,符合加速脑老化和痴呆风险的生物标志物的第一个特征。
3.2.2 认知共变和认知退化
在大型横断面研究中,白质高信号与老年人较低的认知能力有关。与此同时,纵向成像研究表明,白质高信号的发展与一般人群认知能力下降的速度加快一致,AD也是如此。虽然许多研究将认知能力与老年人的白质高信号联系起来,但很少有研究能够控制儿童的认知能力。然而,两项纵向测量认知的研究结果表明,白质高信号的体积可以预测从童年到中年认知能力的下降,以及在控制了童年认知能力之后老年人认知能力的下降。
DTI测量白质完整性。高FA和低MD也与认知能力有关。虽然结果在儿童时期比成年时期更复杂,但有一个普遍的趋势,即大脑中更完整的白质与更高的认知能力相关。从生命开始到青春期,白质完整性与认知能力呈正相关。这种高白质完整性和高认知能力之间的联系在中年人和老年人中一直被发现。虽然有研究表明,脑白质完整性和认知能力之间存在tract-specific的联系,但这些发现是异质性的,尚未描述出一致的脑白质特异性模式。未来的研究需要更大的样本,以更好地理解tract-specific (即脑白质完整性与认知能力之间的关系)。
总的来说,这些发现表明,较低的FA和较高的MD是白质退化的重要指标,而白质退化是由于衰老的大脑结构“脱节”而导致认知能力下降的原因。因此,虽然目前的数据提供了白质高信号、FA和MD与认知能力共变的证据,但需要更多贯穿生命周期的纵向证据来更直接地将白质完整性与认知能力下降联系起来。
3.2.3 与痴呆风险因素的关联
白质完整性与许多影响灰质的痴呆风险因素有关(见2.2.3节)。痴呆风险与白质退化之间最紧密的联系(包括FA的减少、MD的增加和白质高信号体积的增加),都与血管危险因素有关。这一联系在文献中得到了显著的探讨,因为血管疾病使脑血管紧张,最终导致小脑出血,以梗死、少突胶质细胞损伤、脱髓鞘和损伤的形式导致大脑病理。调查特定血管危险因素的研究发现,白质退化与高血压、糖尿病、高胆固醇、肥胖和吸烟之间存在关联。此外,英国生物银行(UK Biobank)进行的一项大型研究发现,血管风险因素与低FA、高MD和更大的白质高信号体积之间存在关联。总之,这些发现与大脑慢性血管紧张导致与年龄相关的白质病理学的假设是一致的。
白质退化也与非血管危险因素有关,如创伤性脑损伤。此外,APOE遗传风险与中晚期白质高信号体积增加有关。最后,白质完整性与预防痴呆的因素有关,包括锻炼和坚持地中海饮食。不过,将这些非血管危险因素和保护性因素与白质完整性联系起来研究要少得多。由于其长期的临床应用,在一些老年痴呆预防试验中,白质高信号已被用作生物标记。这些随机对照试验测试了痴呆干预措施,并测量了白质高信号积聚作为替代结果,这些临床试验的结果好坏参半。少数小型研究发现,血管护理和抗高血压治疗降低了白质高信号的进展。然而,其他更大规模的研究发现,高血压和胆固醇治疗并没有减少白质高信号的进展。与传统的以痴呆患病率和认知障碍作为结果测量指标的抗痴呆干预措施不同,使用白质高信号(或其他成像生物标志物)作为结果测量指标可能使临床试验能够灵活地针对中年群体。未来的研究应该扩大抗痴呆治疗试验的范围,将那些大脑更健康、对干预反应更灵敏的中年人也包括在内。
4. 结论和未来展望
4.1 Summary and Integration: What do we know?
衰老是一个终生的过程,与认知的变化有着动态的关系。在成年人中,衰老通常与认知能力下降和脑组织退化有关。与年龄相关的痴呆症是一生中大脑老化的一个终点,最终导致日常功能的损伤。通过中年预防措施减缓认知老化和痴呆症的发展速度,可能比通过晚年干预来恢复失去的功能更有效。然而,要加速研究和测试早期干预的有效性,还需要一些灵敏的生物标记。总的来说,MRI对灰质和白质完整性的测量有望作为痴呆症风险的早期生物标志物,但还需要进一步的研究。
总的来说,皮层厚度、曲面面积、分数各向异性、平均扩散率和白质高信号显示出与年龄相关的实质性下降,这种下降在中年和老年之间是持续的。它们在不同程度上反映了认知能力和认知能力下降的个体差异,灰质和白质老化轨迹的个体差异与已知的可在中年人中测量的痴呆风险因素有关。有初步证据表明,一些MRI生物标记(灰质、白质、APOE基因)与中年的认知能力下降存在关联。虽然最近在开发更好的MRI测量工具和收集更大样本方面取得了进展,但绝大多数证据仍然是横断面的,目前仍缺乏有关老年痴呆的大型、长期的纵向MRI研究,这对于解释痴呆和加速老化有极大的限制。
4.2 Future Directions for MRI-Based Biomarker Research
目前持续争论的一个问题是正常认知退化和痴呆认知退化的病因在多大程度上是相同的(连续模型)或不同的(分类模型)。如果有共同的病因,那么与年龄相关的痴呆可以被认为是正常认知能力退化的一个极端版本。如果是不同的病因,那么一般人群经历的是与年龄相关的“正常”的衰退,特殊人群有独特的病因导致认知能力衰退。常用于证明分类模型可能性的一个例子是常染色体显性遗传的阿尔茨海默。在常染色体显性遗传的阿尔茨海默病中,症状在生命早期出现,并可归因于特定的遗传机制。然而,即使在常染色体显性遗传的阿尔茨海默病中,症状在40岁之前出现的情况也并不多见,这说明与年龄有关的认知能力下降为疾病的发生奠定了基础。
另一个关键的问题是生物标记物的效果。是的,基于MRI的测量与年龄、认知能力和痴呆风险因素有关,但它们之间的联系有多紧密呢?我们在这些领域有什么预测能力?他们能解释多少年龄和认知能力的差异?这些问题在现存的文献中经常被忽视。相反,神经科学的问题往往被优先考虑,研究人员通过搜索大脑中的体素来寻找与年龄相关的“病变”,在这些体素中,灰质的变化在统计学上与衰老表型有关,而不是询问衰老表型中的变化有多少是由大脑测量来解释的。然而,现在有大量证据表明痴呆风险通常对大脑有广泛的、全局性的影响,因此需要研究整合成像测量中广泛可用的信息来预测痴呆风险,并制定干预措施来预防认知衰退和痴呆。这种方法有望帮助我们最大限度地开发敏感、可靠和可修改的生物标记物,在这些生物标记物中,效应大小和预测能力可以被优先考虑。
使用MRI进行正式预测研究很少的一个原因是MRI数据收集和测量的内在局限性。由于磁共振成像的成本相对较高,一项研究有1000名研究对象都是相当罕见的,更不用说需要数十万人。如果处理不当,这种不平衡可能导致过度拟合和有偏差的预测估计。为了克服这些问题,研究人员不得不减少预测因子的数量,或者通过与剩余样本进行交叉验证来评估模型的预测能力。为了正式确定痴呆症风险和加速大脑老化,这两种方法都被越来越多的人采用。下面将重点介绍一些代表性研究。
虽然很难找到大型MRI研究来收集高质量大脑衰老的纵向测量数据,但几乎所有的成像研究都收集年龄,这是导致认知能力下降和痴呆的最大风险因素。研究人员已经开始利用针对大脑结构测量的机器学习算法来建立年龄预测模型。机器学习算法可以利用并结合MRI图像中成千上万的体素信息来预测被遗漏数据集的年龄。这些丰富的数据使我们能够快速地从MRI中预测年龄,目前最好的算法能够从T1加权像中解释超过90%的年龄变化。这些算法的重要性来自于个体的实际年龄和机器学习算法预测的“大脑年龄”之间的差异。
一个人的大脑年龄和他们的实际年龄之间的差异通常被称为大脑预测年龄差异(brain Predicted Age Difference ,brainPAD)。那些大脑看起来比实际年龄“老”的人的brainPAD为正,而那些大脑相对“年轻”的人的brainPAD为负。回顾我们关于老年痴呆症的中年生物标志物的三个互补特征,brainPAD显示出了新的支持。
首先,从设计上看,年龄是brainPAD的一个固有特征,它对实际年龄的预测能力很强。
第二,多项研究表明,brainPAD与认知能力和认知障碍有关。痴呆、AD、认知能力下降者有较高的brainPAD。此外,被确认为认知能力受损、加速衰老(包括精神分裂症和唐氏综合症)的个体,其brainPAD更高。
第三,brainPAD与痴呆风险因素相关(包括肥胖、糖尿病等)。重要的是,与传统体素水平的灰质关联研究相比,脑龄很容易提供效应大小的估计,可进行中度的病理年龄预测(Cohen’s D = 1.06 in dementia and .45 in mild cognitive impairment)。此外,brainPAD的预测也在不断改进,改进了算法,增加了样本的多样性,改进了输入特征。随着MRI技术的进步,brainPAD和其他MRI生物标记物测量与年龄相关的细微变化的能力也将同步提高。
4.3 Open Questions and the Future of MRI-Based Midlife Biomarkers
虽然有越来越多的证据表明,衰老、认知能力和痴呆风险因素的影响与灰质和白质的减少有关,但我们对中年老化和痴呆之间纵向关系的认识仍有许多空白。一个主要的限制是目前缺乏前瞻性的纵向研究与多个时间点的认知和MRI测量。虽然有大量关于大脑年龄相关变化的纵向MRI研究,但很少有研究对从中年到老年的同一个人的大脑、认知能力和痴呆风险因素进行纵向测量。如果没有对同一个人一生中所有这些变量的纵向测量,就不可能回答许多最重要的遗留问题。
许多开放性问题与灰质和白质变化、痴呆危险因素和认知能力下降之间的时间关系有关。在未来的研究中,需要优先考虑老年痴呆症风险因素的组合和相互作用的性质。例如,肥胖是否只在高血压存在的情况下才会导致脑灰质加速下降?在他们的敏感时期,危险因素是否夸大了他们晚年的大脑完整性和痴呆风险?有证据表明,高血压比老年高血压更能预测中年痴呆,其他危险因素是否也是如此,灰质和白质的减少是否能减轻这些影响?在检测到认知能力加速下降之前,能否检测到MRI生物标志物的细微变化?这些生物标志物能在一个人未来认知能力下降的风险发生之前就预测出来吗?通过对痴呆症危险因素、认知能力和脑成像的寿命测量进行纵向设计,可以开始回答这些问题。
填补这些空白的理想研究应该是一项前瞻性出生队列研究,对认知功能、痴呆风险因素和整个生命周期的脑成像进行重复取样。这将允许对认知变化、大脑变化、痴呆危险因素以及最终的认知障碍和痴呆发病之间的相互关系进行细致的映射。然而,由于资源的限制,以及MRI仅在研究中被广泛应用约30年的历史事实,本研究从未进行过。虽然这种规模的研究需要至少80年才能完成,而且在短期内不太可能实现,但在整个生命周期内测量神经成像和认知的大样本正变得越来越普遍,包括像人类连接体项目生命周期研究这样的大规模研究。
doi:10.1016/j.arr.2020.101075

微信扫码或者长按选择识别关注思影
如对思影课程感兴趣也可微信号siyingyxf或18983979082咨询。觉得有帮助,给个转发,或许身边的朋友正需要。请直接点击下文文字即可浏览思影科技其他课程及数据处理服务,欢迎报名与咨询,目前全部课程均开放报名,报名后我们会第一时间联系,并保留名额。
更新通知:第十届脑影像机器学习班(已确定)