精神分裂症是一种高度遗传性精神疾病,其特征是脑功能的失调。然而,多基因危险因素与连接组学广泛的神经机制之间的关系尚不清楚。本研究结合来自HCP的623名健康白种人的遗传和多范式功能磁共振成像数据发现精神分裂症的多基因风险分数越高,与包括视觉系统、默认网络、额顶网络系统的大范围脑功能网络低连接的相关性就越显著。在多个fMRI范式中均观察到这种相关性,表明精神分裂症个体大脑状态独立性神经表型的易遗传性的基础。
此外,使用从CNP获得的独立临床数据集,进一步证明了精神分裂症患者中识别的连接性降低网络,且与一般认知能力具有显著相关性。这些发现在系统水平上为精神分裂症多基因风险与广泛功能连接组的关联提供了证据,并提示感觉-认知信息整合的损伤可能是导致精神分裂症发病的大脑遗传效应的一个标志。本文由耶鲁大学学者发表在Molecular Psychiatry杂志。
前言
精神分裂症的高遗传率使对其遗传机制的理解变得至关重要。由于遗传效应在人类行为方面的作用是由神经回路功能介导的,因此研究与精神分裂症遗传风险相关的功能网络变化是实现这一目标的关键策略。迄今为止,这类研究主要集中在对典型精神分裂症风险基因(如DRD2、ZNF804A和CACNA1C)与神经影像学关系的探究,或基于一级亲属或孪生子数据对“影像中间表型”进行探究。这两种探究的局限具有互补性:前者由于单个遗传标记对疾病风险影响极小,而后者由于无法衡量遗传风险程度的个体差异,无法将遗传风险与共享非家族遗传风险分离开来。
在个体层面上评估遗传风险的一种方法是计算“多基因风险评分(PRS)”,它本质上代表了一个人发展为精神分裂症的整体易遗传性。通过这种方法,每个个体都可以用一个单独的PRS指数表示,有助于对个体基因组变异相关神经生物学表型进行评估。结合PRS和功能性神经影像学资料,以往研究表明精神分裂症PRS的变化部分程度地解释了多个脑区功能的个体差异,如工作记忆期间的前额叶皮层活动、情景记忆中的海马活动,预期奖赏时腹侧纹状体的活动。尽管这些研究为精神分裂症遗传风险与脑功能间的相关性提供了重要证据,但它们只关注基于特定成像范式的先验区域。当下,PRS是否以及如何影响整个大脑层面和独立于范式外脑功能连接仍是一个关键但尚未解决的问题。
该问题的探究,对于促进精神分裂症发病机制的认识尤为重要。首先,精神分裂症具有神经失连接的特点,且广泛分布于整个大脑,而非局限于某一区域。因此,与遗传风险相关的连接改变也可能涉及广泛区域及连接。对这些区域和连接的识别将有助于阐明大脑容易受遗传风险因素影响的部分,并且可能与精神分裂症的病理生理学相关。另一方面,由于PRS(多基因风险评分)本身反映个体特征,理论上在大脑层面与某些神经“特征”相关,这些特征独立于大脑参与的任何功能“状态”。虽然先前的研究结果可能只反映了一种状态依赖性关系,但寻找状态独立性PRS神经生物学关联可能会让我们对精神分裂症的遗传机制有更为基本的了解。
本研究使用人类连接组项目(HCP)中的fMRI数据探究个体遗传风险的全连接组关联。按照先前发表的流程,作者在623名健康参与者的样本中为每一个体构建了独立于范式的全脑网络,这些参与者共完成了8个fMRI范式,且基于网络进行统计分析,将个体的连接模式与其PRS进行分析。对于观察到的连接组学的关联,本研究从精神病学基因组学联盟(CNP)抽取完全独立样本,对发现的临床和行为相关性进行进一步检验。具体讲,作为概念的证明,本文研究了精神分裂症患者PRS相关脑网络的连接性是否会改变,是否会与患者的认知和临床症状相关。有证据表明存在影像表型且与精神分裂症的行为表型相关,本研究期望在脑连接和个体PRS(多基因风险评分)之间看到显著独立于范式的关联。
材料与方法
被试:本研究包括两个单中心的样本。来自HCP中的样本包括623名健康受试者(年龄28.86±3.63,男性:302名)。被试入组标准为:(1)白种人(2)被试具有八种范式(静息态、工作记忆、情绪处理、赌博、运动、社会认知、关系处理和语言处理)fMRI数据;(3)被试遗传数据可用。所有被试均提供书面知情同意书。
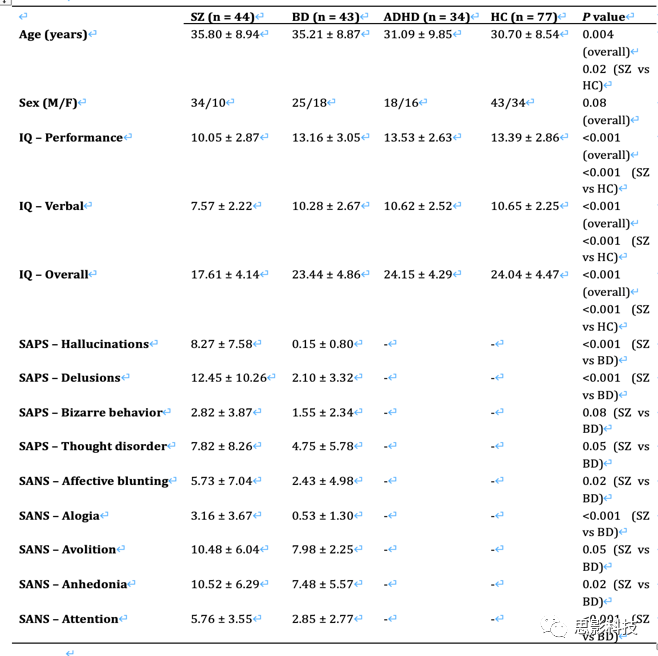
CNP样本用于检查观察结果的临床相关性(表S1),含44名精神分裂症患者(SZ,年龄:35.80±8.94岁,男性:34名)、43名双相情感障碍患者(BD,年龄:35.21±8.87岁,男性:25名)、34名注意缺陷多动障碍患者(ADHD,年龄:31.09±9.85岁,男性:18名),77名健康对照(HCs,年龄:30.70±8.54岁,男性:43名)。所有被试均完成了队列中的七个范式(静息态、冒险、工作记忆、情景记忆编码、情景记忆提取、信号终止和任务转换)。
表S1:CNP样本临床和人口学资料
遗传数据处理:
数据处理流程如图1所示。输入的基因数据从https://www.ncbi.nlm.nih.gov/projects/gap/cgi-bin/study.cgi.上下载。在计算PRS之前,使用PLINK 1.9进行数据标准质控。具体来说,SNPs基因型确定性<0.9,最小等位基因频率<0.05、基因型呼叫率<0.95、Hardy-Weinberg平衡概率<10-6。此外,由于主要组织相容性复合体区域的高度连锁不平衡(LD),6号染色体26000-33000kb之间的所有SNP都被排除在进一步的分析之外。最终样本包含了HCP数据中623个人的5732973个SNP。
使用基于精神病学基因组学联盟(https://www.med.unc.edu/pgc/results and downloads)全基因组关联研究(GWAS)结果的PRSice工具箱进行PRS分析。在500kb的窗口内,基于R2<0.2的LD阈值,将所有在基数据集和目标数据集间匹配的SNP聚集。 这些得分被计算为每一个体的全基因组风险等位基因的总和,并通过精神分裂症的相应优势比进行加权。研究报告了基于GWAS P阈值(5×10-8)的主要发现。此外,为了检验研究结果的稳健性,还计算了一组其他阈值范围为5×10-7-5×10-2的PRSs。
影像数据处理:
预处理影像数据下载于https://db.humanconnectome.org/。每一个个体独立范式网络使用主成分分析(PCA)进行计算。从预处理的图像中提取大脑中270个节点(将全脑分割为了270个脑区)的平均时间序列。对这些时间序列进行了扫描仪器、噪声、生理噪声和头部运动的校正,且利用Pearson相关在每个范式中为每个被试生成270×270的连通矩阵。
对每个被试的八个范式连接矩阵进行矢量化、连接所有八个成分并用奇异值分解法分解为一组主成分。根据定义,PCA分析产生的第一PC分数提取了主体中所有范式的大多数共享方差,因此反映了个体化的状态独立网络架构(图S1)。这些个体特异的第一PC矩阵被称为“跨范式连接(CPC)矩阵”,并用于进一步分析。
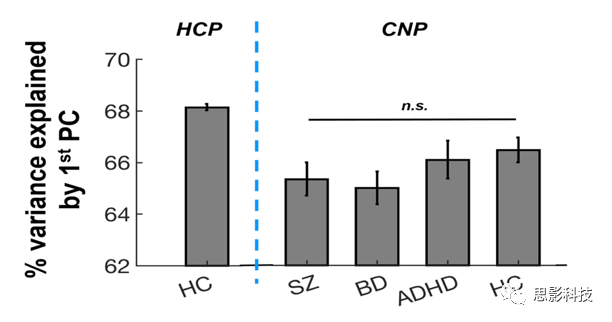
图S1:跨范式分析中第一主成分解释的方差百分比。
HCP样本的网络统计分析:
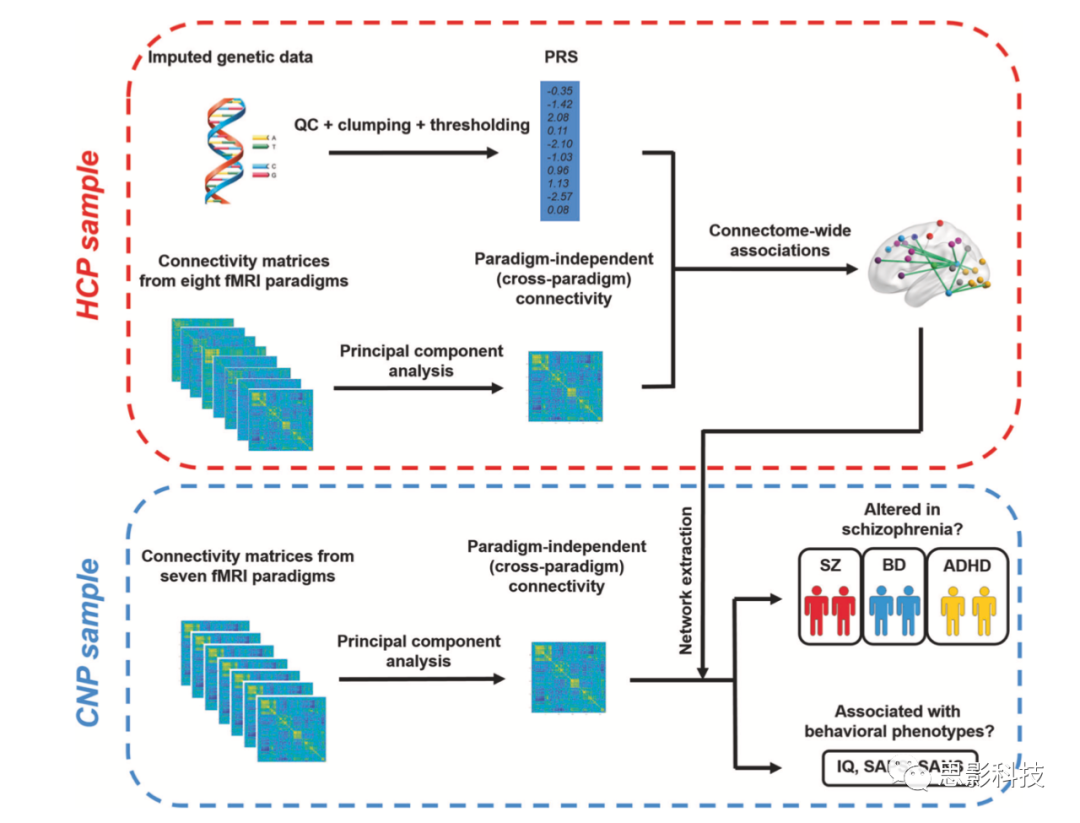
图1.本研究作者所使用数据处理流程
HCP为作者根据270个节点提取出的时间序列构建的全脑网络,通过主成分分析方法抽取出能解释所有不同范式网络的最大方差的主成分作为网络矩阵和PRS得分进行相关,CNP为另一站点数据,进行了相同的网络分析,然后与临床数据进行了相关分析
采用网络统计(NBS)分析方法,探究PRSs与全连接组间的关联。初始线性回归模型应用于CPC矩阵每一条边,PRS、年龄、性别、所有范式的相对头动值(FD)作为回归因子。该步骤生成一个P值矩阵,表示接受每个边的PRS效应的零假设的概率。然后将P值<0.001的所有边阈值化为一组超阈值链接,并使用广度优先搜索来识别该集合内的连接团块。
通过置换检验(10000次)控制FWE。每个被试的PRS是随机的,且在每次置换检验时,在相同的阈值下重新计算所识别团块的最大效应。给定团块的校正P值由导出的团块大小在置换分布中的比例决定,该比例大于观察到的PRS效应。
CNP样本临床系相关结果:
本研究使用CNP样本来检验在精神分裂症患者中是否可以检测到已鉴定的连接组学发现,以及该发现是否与患者的行为缺陷有关。CPC分析遵循与上述完全相同的流程。在获得每一个体的独立范式CPC矩阵后,从CNP样本中的CPC矩阵中提取出表明精神分裂症多基因风险的识别网络,并进一步求均值生成特定的被试指标。
为检验精神分裂症患者是否存在这种网络连接的改变,对协方差模型进行分析,以比较各组间的指标,包括年龄和性别。对显著的主效应,进行事后分析,比较各组之间的差异。经Bonferroni校正后,显著性设为P<0.05。为检验所识别的网络与行为表型之间的关系,对年龄和性别进行控制后进行了皮尔逊偏相关分析,测量其对智商和阳性症状评估量表(SAPS)及阴性症状评估量表(SANS)得分的影响。
结果
PRS的全连接组关联:
在HCP样本中,CPC矩阵解释了所有范式中连接矩阵总方差的68%(图S1)。NBS分析显示精神分裂症PRSs与69条边连接的54个节点的大规模网络间存在显著相关(PFWE<0.05)(图2A)。这些结节主要分布在大脑视觉系统(包括跟骨沟、枕上、枕中、枕下回、舌回、梭形回)、默认网络(包括额叶内侧皮质、颞中、颞下回、楔前叶)和额顶系统(包括额上下回和顶叶下皮质)。除了这三个主要系统外,尽管节点较少,但该网络还涉及其他几个系统,如感觉运动、听觉、凸显、注意和皮层下等。较高PRS与识别网络中所有较低连接相关。PRSs与网络的平均CPC之间的相关系数为R=-0.37(图2B),表明检测到的约网络总方差的14%(R2)可以用精神分裂症的多基因风险来解释。
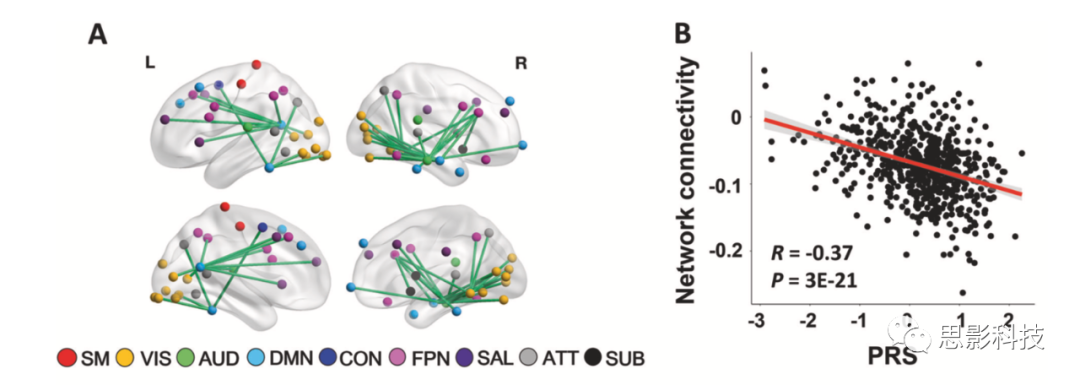
图2A/B:HCP数据集中PRS的全连接组关联
为进一步验证已检测到的关联独立于范式外,不受任何特定fMRI任务驱动,本研究提取了八个范式中每一范式中所识别网络的功能连接,并检验了这些指标与PRSs的相关性。正如预期,所有8个范式都显示出显著的相关性(R<-0.13,P<0.001,图2C),表明检测到的连接组关联确实反映了一种独立于fMRI范式的特征样神经表型。
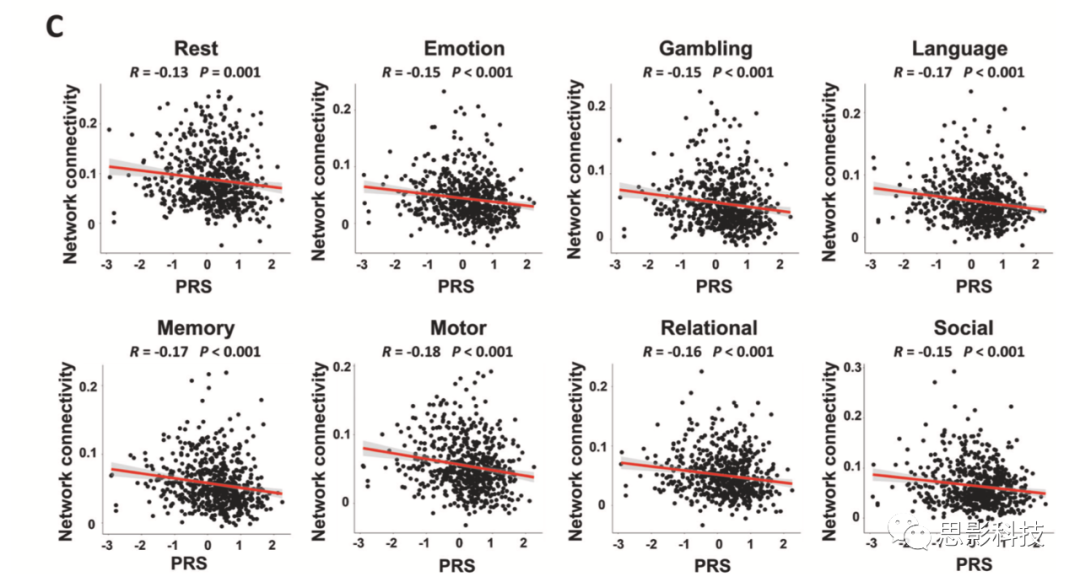
图2C:八个研究范式所识别的网络功能连接强度与PRSs的相关分析。
为了检验连接组结果的稳健性,进一步计算GWAS P值阈值范围从5×10-7到5×10-2的PRS,并将检测到的网络的连接与这些PRS进行相关分析,均存在显著相关性(R<-0.10,P<0.02,图S2),表明检测到的连接组相关结果不限于用于PRS计算的预选阈值(即GWAS显著)。
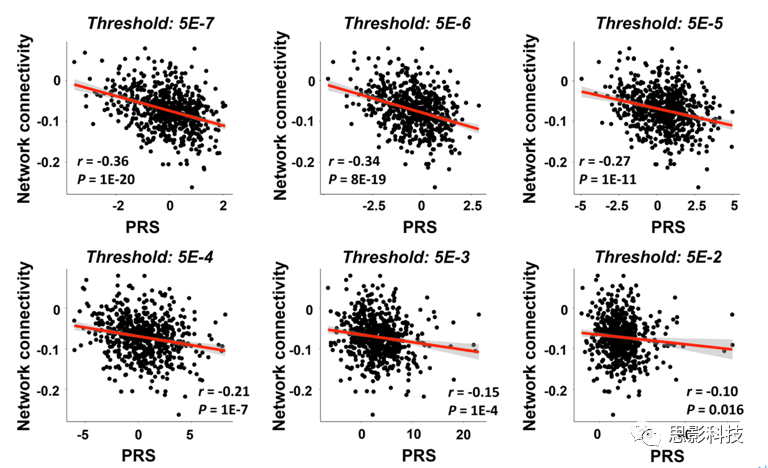
图S2:连接组发现在多个GWAS P值阈值上的稳健性
为了确保观察结果不是因头动驱动,检查所有范式中检测到的网络连接和平均FD之间的关联,未发现显著相关性(R=0.06,P=0.14),表明检测到的连接组关联不太可能由头动驱动。
观察网络在患者中的呈现:
在CNP样本中,检测到的网络连接在各组之间具有显著差异(图3A)。事后分析显示,精神分裂症患者与对照组相比,显著的连接下降是造成这种差异的原因。随着各组间精神分裂症的遗传接近度增加(即SZ<BD<ADHD<HC),识别网络的连接呈梯度下降,相比之下,其他组间并无显著差异。
认知与临床症状相关:
精神分裂症患者脑网络连接与智商得分呈显著正相关(R=0.33,P=0.03),而健康受试者脑网络连接与智商得分无显著相关(R=0.06,P=0.64,图3B)。联合样本中的相关性仍非常显著(R=0.29,P=0.001),这表明患者在PRS相关网络中连接较低其认知能力差。考虑到性别可能在精神分裂症患者的认知功能中起着重要作用,本研究进一步分离性别后对这种联系进行研究。结果发现,患者中检测到的相关仅在男性中显著(R=0.39,P=0.02),而在女性中不显著(R=0.14,P=0.71,图3C)。这可能提示多基因风险和性别之间可能存在相互作用,从而导致精神分裂症的认知缺陷。
在精神分裂症患者,以及在精分和双相组合样本中,所识别的网络连接与临床症状之间并未显示出任何显著相关。
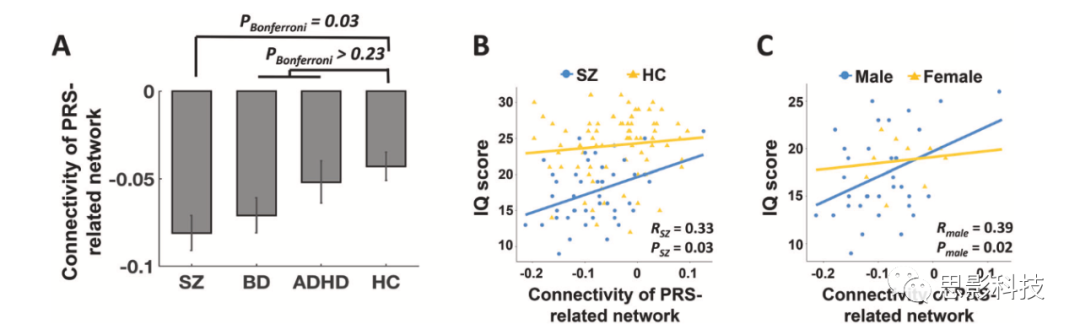
图3A/B/C: CNP数据中PRS相关网络的临床症状和认知相关性分析
讨论
结合HCP数据中的遗传和多范式fMRI数据,本研究观察到健康白种人中精神分裂症多基因风险的全连接组学的显著关联。已识别的相关网络连接主要涉及视觉系统、默认网络和额顶网络内部和之间的连接,较高的PRS与此网络中较低的连接相关。此外,利用独立的临床数据验证,进一步表明,精神分裂症患者同一网络索引遗传易感性的连接降低,且与智商得分相关。总的来说,本项研究首次为精神分裂症PRS(多基因风险评分)相关的全脑神经表型提供了证据。
先前基于高危亲属和对照组之间的比较,已经证明了与精神分裂症遗传风险相关的大量以连接体为基础的中间表型,主要包括前额叶皮质、外侧和内侧颞叶皮质、顶叶皮质和皮质下的连接。此外,少部分关注PRS对脑网络连接影响的研究,发现风险分数与范式依赖性功能连接指标呈显著负相关,包括静息态的前额叶皮层与海马体的连接,情绪面孔加工过程中视觉皮层与边缘系统的连接。
目前的研究结果与先前的发现在位置和方向上高度一致,表明在视觉、默认和额顶系统等主要大规模网络中, PRS较高的个体功能连接较低。值得注意的是,本分析基于独立于任何特定fMRI范式的个体连接模式,且结果在不同的fMRI范式中得到了有力的验证,表明这些发现可能反映出精神分裂症个体遗传脆弱性影响的独立状态的神经表型。当与健康被试相比,在同一网络中精神分裂症患者的功能连接降低,但其他主要精神障碍患者并未出现,表明该网络与精神分裂症尤为相关。总之,这些结果为将来的遗传学和临床学对精分风险的研究提供个体化影像连接组表型指标。
已知观察到的网络中的区域和系统与精神分裂症有关。具体地说,初级感觉系统(如视觉皮层)功能障碍可能会损害高阶认知系统的视觉感知和视觉信息输入,因此,被认为与幻觉和情绪失调等症状有关。额顶网络是人类主要的认知控制系统之一,其功能障碍与患者认知缺陷相关的成熟表型。默认网络的异常活动和功能连接可能导致患者内在集中思维与外在目标导向行为之间失衡,从而导致患者注意和凸显信息处理的紊乱。这 三个系统的功能连接与PRSs间的负相关可能表明精神分裂症遗传易感性的累积可能会导致大脑皮层感觉-认知信息整合的困难,进而使个体更容易发展成精神障碍状态。 上述相同网络的功能连接与神经分裂症患者IQ呈显著相关,进一步证实了这种解释,表明观察到的网络的功能紊乱的确加剧了认知功能的损害。值得注意的是,认知缺陷是精神分裂症和精神病性疾病的一个广为所知的特点,长期以来被认为是临床症状异常的基础,并且能够预测疾病的发展。
总结:
这篇文章算是探索任务态脑网络和静息态脑网络相关研究如何脱离范式而进行一般性网络分析并且能够和临床因素、基因表型等疾病表型进行综合性研究的重要文献。由于任务态研究受到研究范式的影响,不同研究之间的可比性是较差的,但是作者利用主成分分析的方法,选择能够最大化解释脑网络中方差变异的主成分来进行不同研究间的统合,可以说巧妙的避免了HRF加权在任务态研究和静息态研究中的不同,从而可以更好的进行不同研究范式间的更具普遍性的探索性分析。但同样,本研究也存在一些不足。
首先,本研究只探究了精神分裂症常见基因变异加性效应的神经相关性。然而,双生子和基于SNP研究之间估计遗传力的差异(0.8对0.2)表明,非加性遗传效应实际上导致了精神分裂症的大多数遗传风险。这些非加性遗传效应背后的神经机制在很大程度上仍旧不为所知,应该在未来进行深入研究。第二,所确定的连接组关联可能只反映了精神分裂症的部分加性遗传效应。虽然本研究基于最严格的全基因组阈值,以最大限度地“真实”遗传信号和最小化不相关的遗传干扰报告了研究的主要发现,但它可能无法捕捉到全部的加性遗传风险。然而,这种发现跨越多个阈值的稳健性进一步支持了一种观点,即加性遗传风险通常会破坏感官和认知系统之间的连接,在这个意义上,本研究结果可能反映了这种影响的下限。第三,本研究缺乏独立样本重复已观察到的与PRS的连接组学关联。第四,CNP样本相对较小,因此观察到的已识别网络的临床相关需要在较大样本中进一步重复。第五,本研究中的两个样本使用了不同的fMRI范式。然而,这种差异实际上会加强观察到的连接组学关联是状态独立的论点。
综上所述,利用遗传和多范式fMRI数据进行研究表明,在健康成人中,较高的精神分裂症PRSs与较低的视觉、默认网络和额顶叶网络的功能连接降低有关。在精神分裂症患者中该网络连接的降低,与患者的一般认知能力有关。
原文:
H Cao, H Zhou, TD Cannon - Molecular Psychiatry, 2020
https://doi.org/10.1038/s41380-020-0699-3

微信扫码或者长按选择识别关注思影
如对思影课程感兴趣也可微信号siyingyxf或18983979082咨询。觉得有帮助,给个转发,或许身边的朋友正需要。请直接点击下文文字即可浏览思影科技其他课程及数据处理服务,欢迎报名与咨询,目前全部课程均开放报名,报名后我们会第一时间联系,并保留名额。
更新通知:第十届脑影像机器学习班(已确定)
磁共振脑影像结构班(预报名)
弥散磁共振成像数据处理提高班(预报名)
小动物磁共振脑影像数据处理班(预报名)
更新通知:第二十届脑电数据处理中级班(已确定)
脑电信号数据处理提高班(预报名)
眼动数据处理班(预报名)
近红外脑功能数据处理班(预报名)
数据处理业务介绍:
招聘及产品:
招聘:脑影像数据处理工程师(重庆&南京)