本文重点:
血氧水平依赖(BOLD)信号间接提供了神经元放电的信息,未能在较快的时间尺度上捕捉到正常生理功能的进程。本文使用fMRI引导的经颅磁刺激(TMS)和同步脑电图(EEG)来表征高时间分辨率的脑网络动态变化。用TMS诱发对默认网络(DMN)和背侧注意网络(DAN)的可控的扰动(这里用的是perturbation这个单词,可理解为通过神经刺激方式对刺激靶点脑区及相关网络的功能干扰)。源定位水平上EEG传播模式是特定于网络的,并且在间隔1个月的扫描中具有高度重复性。此外,高阶认知能力的个体差异与DAN和DMN间TMS传播模式的特异性显著相关,但与静息态EEG无关。说明了TMS-EEG基于扰动的生物标记物,在高时间分辨率下表征个体大脑网络动力学的潜力,并潜在地提供了对其行为意义的进一步洞察。可以作为一种新兴的联合方法对个体大脑网络动力学进行探测。
该文章由Beth Israel Deaconess Medical Center的研究者发表在PNAS上。
前言
表征大脑自发活动在认知和行为中的功能作用,导致了人类大脑功能研究的基础范式发生转变。大量的fMRI研究表明,空间上遥远的大脑区域自发的BOLD信号存在时间上的相干波动,并在静息态中形成一组不同的功能网络(RSNs)。这些RSNs与任务执行过程中激活的网络紧密重叠,即使在没有外部刺激的情况下也为信息传输提供了支撑。RSNs反映了健康和异常大脑活动的潜在功能结构。因此,越来越多的临床和转化性神经科学研究集中在基于fMRI的分布式大脑网络内和分布式大脑网络间的连接动力学,并且作为诊断以及确定各种神经和精神疾病的治疗目标的重要潜在方法。
然而,经过二十年的研究,我们对大规模分布式脑网络功能相关性的理解仍然有限。BOLD信号提供了神经元活动的间接测量,反映了缓慢演变的血流动力学反应,通常无法捕捉RSNs持续振荡的丰富的时间动力学特性。此外,fMRI测量了静息状态的连通性,确定了大脑活动中的双变量相关性,但所确定的网络关系的因果意义仍不清楚。
经颅磁刺激和脑电图的同步结合(TMS-EEG)可能有助于解决这些局限性。TMS提供了一种独特的方法来扰动RSNs的单个节点,探测局部和分布网络的响应,从而表征所谓的基于扰动的连接。任务诱发的大脑激活可能涉及各种中间皮质/皮质下过程,并高度依赖于被试对给定任务的参与/认知策略,TMS与其不同,可以直接干扰特定的皮质区域,具有良好的空间分辨率,同时需要被试/患者的参与程度很小。同步记录脑电可以评估TMS诱发的效应及其在功能连接的皮层区域的传播。越来越多的证据支持了这样的TMS诱发电位(TEPs)在表征健康和病理性大脑中的作用。
此外,TMS-EEG可能会发现大脑电生理的细微变化,而这些变化在传统的静息态EEG分析中并不明显。例如,即使在常规头皮脑电特征不能揭示疾病特异性改变的情况下,TMS-EEG也能够识别大脑反应的异常,从而区分出意识较弱患者和持续植物人状态的患者。然而,缺乏关于使用这种TMS-EEG来测量大脑网络动力学的证据。将大脑网络的改变以及网络间的相互作用视为病理状态和认知功能的潜在生物标记物十分重要。例如,在阿尔茨海默病和额颞叶痴呆患者中,使用fMRI记录到了相同的RSNs (DMN和ASN(前部突显网络))的改变;尽管这两种情况都有显著的神经病理基础,但前一组患者显示DMN-ASN功能连接增加,而后者相反。TMS-EEG是否能够测量这种细粒度的网络水平动力学、是否有可能显著提高基于标准fMRI/EEG的生物标记物的分辨率仍然是悬而未决的问题。
在这里,作者使用fMRI引导的TMS-EEG来选择性地干扰DMN或DAN这两个网络中的两个相邻的顶叶节点 (图1B),这两个节点被认为分别是内在和外在定向注意过程的基础。在fMRI中,当注意到外部刺激或一项任务时,“任务消极型”DMN(默认网络)保持相对沉默,但在不受约束的静息态下表现出更多的活动。相反,“任务积极型”DAN(背侧注意网络)则相反,在注意力要求高的任务中活动增加,而在静息态时活动减少。此外,这两个网络间功能连接模式的中断或异常,与个体在一些认知功能、运动行为以及各种神经和精神障碍的症状方面的失调有关。然而,基于fMRI不能清楚观察到的这两个网络相互作用的空间−时间动力变化是否具有因果性。通过采用非侵入性和个体化的网络扰动方法,同时使用EEG进行全脑神经成像,这两个功能相反的网络之间的关系可以用高时间分辨率来表征。
本文的假设是,用TSM刺激,DMN或DAN将显示不同的空间−时间动力学,可以被源重建的高密度脑电数据所测量,并且EEG可以反映通过fMRI测量到的DMN和DAN连接的负相关模式。此外,通过在1个月内进行反复采集,证明特定网络下TMS诱发的EEG响应具有可重复性。最后,考虑到DMN/DAN与认知(特别是流体智力和抽象推理)之间的正相关,本文假定TMS诱发的皮层反应与认知的个体差异有关,并且TMS后DMN/DAN“分离”的程度将与更高的智力测量表现呈正相关。
方法
结构磁共振数据采集
对所有被试进行T1加权(T1w)结构MRI扫描用于神经导航。3T磁共振(GE Healthcare,Ltd.),使用三维扰相梯度回波序列:166层轴向切片覆盖全脑;240mm各向同性FOV;分辨率0.937 mm×0.937 mm×1 mm;翻转角度15°;回波时间(TE)/重复时间(TR)≥2.9/6.9ms;持续时间≥432s。
静息状态fMRI数据及其预处理
在3T GE扫描仪上采集静息态fMRI数据,共3次,每次5min,扫描参数为:轴面(自下而上),FOV=240 mm,TE=25ms,TR=3196ms,层厚=2.5 mm,翻转角=90°,体素大小1.87×1.87×2.5。使用FMRIprep(v1.2)对静息态fMRI数据进行预处理。为了使功能网络个体化,使用了18个功能网络,包括来自YEO-2011组平均功能网络的17个网络,以及代表手部区域的额外网络(SI附录方法,欢迎添加微信siyingyxf或19962074063获取)。
基线评估
每个被试的基线评估共5小时,接受仔细的认知和运动能力评估。认知评估包括改良的爱丁堡利手问卷和NEO人格问卷(NEO-FFI)。总共14个认知任务,涵盖如注意力、抽象推理、抑制、语言和视觉空间工作记忆以及转换,用E-Prime 2.0呈现。作为初步分析,目标是得到以网络为靶点的个体TEPs与流体智力(Gf)和晶体智力(Gc)相关,Gf代表与假设检验和推理相关的抽象推理能力(通过SM测量);Gc代表语义知识(通过TOPF测量)。作为控制任务,还测试了SRTT。SRTT是一种广泛使用的运动任务(SI附录方法)。对于每项任务,记录准确率和反应时间(RTs),计算IES,即认知任务绩效得分。IES平衡了持续认知测试期间观察到的速度和准确率。
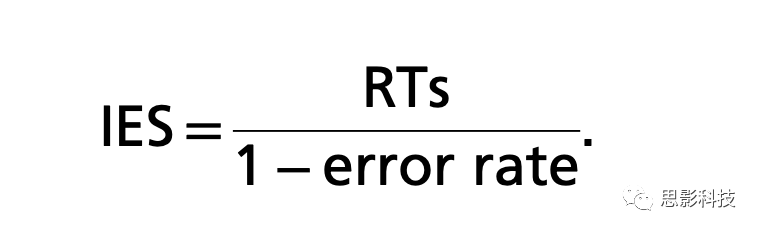
TMS
TMS采用与MagPro X-100刺激器连接的具有动态流体冷却功能的八字形线圈(Mag Pro75 mm Cool B-65;MagVenture A/S)。将T1w像导入BrainSight TMS无框架导航系统,配准到解剖图中用于实时监测线圈位置。记录右侧第一骨间背侧肌(FDI)和拇短展肌(APB)的运动诱发电位(MEPs)。将Ag-AgCl表面电极放置在肌腹和肌腱上,接地电极放置在右侧尺骨茎突上。
脑电
使用与TMS兼容的放大系统(actiCHamp)收集全头皮64通道EEG数据,按照扩展的10-20国际系统坐标贴放电极。参考电极为Fp1。在1000 Hz的采样率下,电极阻抗保持在5kΩ以下。使用BrainCHamp DC放大器将信号数字化,并连接到BrainVision Recorder软件(1.21版)进行在线监测。使用BrainSight TMS无框架导航系统将头皮电极位置与MRI结构像配准。
TMS靶点
为了识别个体的TMS靶点,使用了分割为七个网络的组级静息态功能网络图。七个网络分别对应于视觉、躯体感觉、边缘、背侧注意、腹侧注意、默认和额顶RSNs。使用了每个RSN的置信概率度图(−1~1),值越大表示置信度越高。通过使用来自1000名健康被试的组级功能划分和置信度图,能够找到每个网络中最一致和最可靠的区域,增加了TMS-EEG发现的泛化性能。首先使用Freesurfer的球形配准将七个网络的功能皮层图谱和置信度图映射到被试的皮层表面(图1A)。然后重新采样到结构T1w磁共振影像中。通过置信图对每个网络中的体素进行加权,并分别选择右角回和右顶上回中置信度最高的体素进行DMN和DAN刺激(图1E)。每个被试的DMN和DAN靶点映射到MNI空间,以显示目标靶点在个体之间的可变性(图1F)。
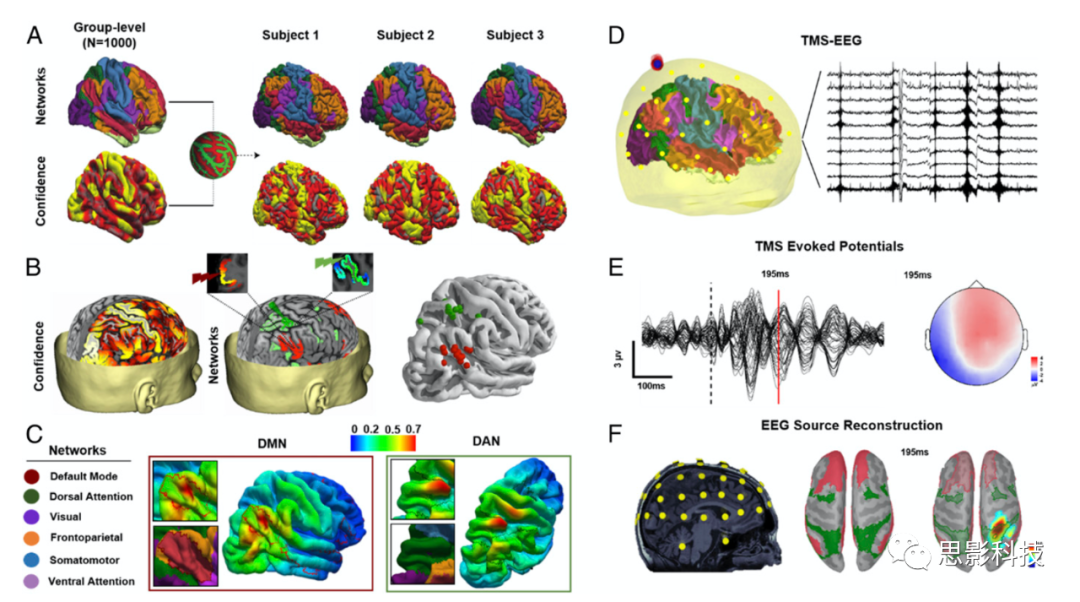
图1 靶点选择
实验程序
被试舒适地坐在一把可调节的椅子上。每次训练开始时确定在FDI肌肉诱发MEPs的运动节点,通过传递单个TMS脉冲,并在每个点2~3次刺激后以小增量步长移动TMS线圈,以相对于矢状面45°旋转的方式在左侧运动皮质的手部区域上方(在皮层中诱发从后到前的电流)。运动节点被定义为,与APB肌相比,使用最小的刺激强度,单脉冲TMS在FDI肌中引起更大和更一致的MEPs。
通过单项电流波形施加10个脉冲,在最小刺激强度下诱发至少五个MEPs(≥50μV),以此来确定静息态运动阈值(RMT)。根据国际临床神经生理学联合会的安全建议,被试被要求在试验期间戴上耳塞,以保护听力,并将外部噪音降至最低。TMS线圈下面放置一层薄薄的泡沫,以最大限度地减少躯体感觉对TMS-EEG电位的干扰。为了最小化与TMS相关的AEPs,在整个TMS刺激中使用听觉白噪声屏蔽。确定RMT之后,总共向每个刺激靶(DMN的角回节点和DAN的顶上小叶节点发送120个单TMS脉冲,强度为120% RMT,刺激60次,间隔3000~5000ms (图1A)。操作员持续监测被试的清醒情况,提示他们睁开眼睛。每个被试相隔4周完成两次相同的实验。
脑电数据处理
使用EEGLAB 14.1的脚本离线执行所有预处理。包括基线校正,去除EEG数据中刺激前期TMS脉冲伪影,利用fast ICA去除TMS诱发的高幅值信号以及EMG伪迹,线性插值,高通滤波,利用全脑平均信号校正,利用PCA降维,再次利用fast ICA去除眼动和肌电噪声以及单个电极的噪声,心电和听觉诱发电位,最后低通滤波(细节见SI附录)。EEG通道分析
TMS刺激后对TEPs(TMS诱发电位)进行全脑平均场功率(GMFP)分析量化整体皮质激活水平(参见SI附录,方法和图S2)。GMFP可用于测量整个大脑对TMS的反应。还进行了局部平均场功率(LMFP)分析,以确定局部诱发活动(见SI附录,方法和图S3)。TEP时间序列还用于检测两次实验中TEP反应的重复性。
脑电源重建
使用BrainStorm进行所有TMS诱发的EEG源重建。首先,从BrainSight中提取每个被试的通道位置和解剖标志 (鼻根、左侧耳前和右侧耳前),并将其配准到BrainStorm中的个体MRI结构像上(图1C)。接下来,加载每次刺激前500ms和刺激后1000ms的脑电数据,并把所有的实验平均(图1B)。使用对称边界元(boundary element method)算法计算神经电场正演模型,使用默认参数设置。使用TMS刺激前作为基线(−500ms至0ms),从单次实验中估计噪声协方差。使用最小范数估计(MNE)方法,结合动态统计参数映射,将源偶极子约束到皮层表面,对皮层源进行反演建模。脑电源重建的结果是每个皮层体素的MNE电流密度时间序列。
脑电源指标
首先从DMN(图1C中红色阴影区域)和DAN(图1C中绿色阴影区域)提取平均电流密度时间序列,并将其投影到每个个体的表面空间上。为了检查不同刺激条件下TMS诱导的振荡特性,首先计算了每个网络的事件相关谱扰动(ERSPs)。使用开放源码的EEGLAB函数(newtimef),使用 Morlet小波(周期0.5-3),500ms的时间窗,每次迭代滑动20ms。对ERSPs进行基线标准化(-500ms至0ms),并使用bootstrap确定刺激后的显著激活。
然后,我们根据噪声协方差将电流密度归一化(z得分),校正得到时间序列用于时域分析(图4B上)。最后计算了在TMS前(−500ms到−100ms;图4B下)和TMS后(15ms到400ms)中每个网络内所有皮质的激活。所得到的电流密度z分数和,表示给定时间窗内每个RSNs图中的源重建皮层活动的总量。
本文还检查了TMS后特定网络激活程度是否与认知能力的个体差异有关。为此,通过简单计算每种刺激条件下,TMS诱发刺激的网络活动相对于非刺激网络的平均百分比来量化NES,NES用于网络特定性和认知得分之间的双变量相关性计算,如下所示:
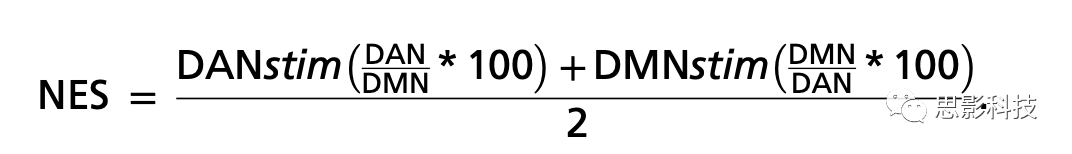
统计分析
利用Matlab统计工具箱17A的自定义脚本执行所有统计分析。为了比较刺激条件之间的GMFP和LMFP时间序列,执行了基于集群的置换配对t检验 (n=10000)(参见SI附录)。使用配对样本t检验来比较TMS前后条件下源处激活值的总和。用单因素方差分析比较不同刺激条件下的GMFP值总和。以两次实验为被试内因素,采用重复测量方差分析进行多重比较,采用2×2方差分析(刺激条件:DAN与DMN)×2(网络图:DMN与DAN),检测刺激条件对TMS前后网络激活的影响。采用Bonferroni校正,以检验不同刺激条件下网络活动差异是否具有显著主效应。利用皮尔逊积差相关系数来测量两次实验TEP的重复性。使用散点图进行简单的线性回归,以计算NES与认知表现之间的关系。所有统计分析均设显著性水平(P<0.05)。
结果
TMS诱导的皮层兴奋揭示特定网络的空间−时间动力学
图2和图3提供了刺激后DAN和DMN归一化源激活模式的空间分布。在TMS到达DAN的顶叶结点后,EEG源主要围绕左右半球的顶上回,与DAN的顶叶地形图高度重叠(图2)。
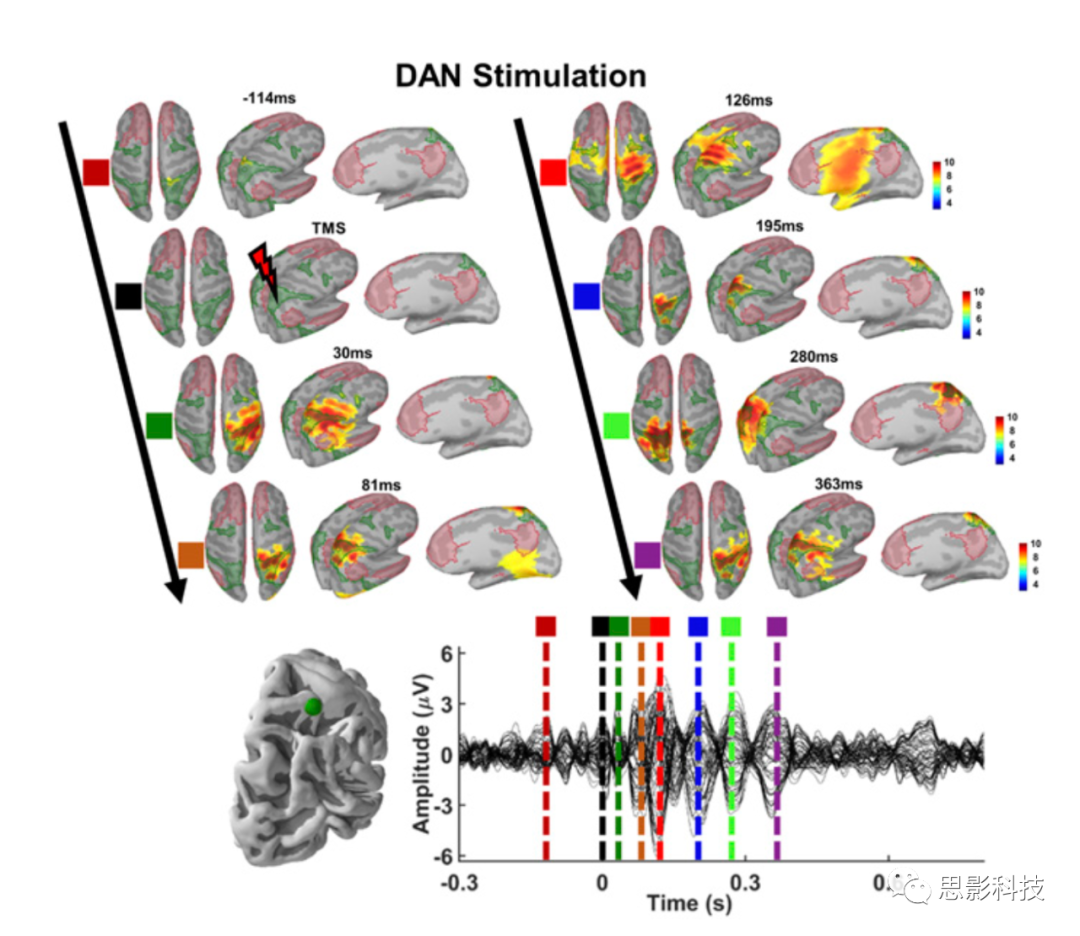
图2 TMS后DAN的源激活模式
另一方面,对DMN施加TMS后,脑电源投射到DMN的额中线和顶区(楔前叶)(图3)。刺激网络中活动的增加不仅局限于刺激部位,而且特异性地传播到同一网络的功能连接的远端区域,揭示了TMS刺激某一节点,可以诱发特定网络的激活。
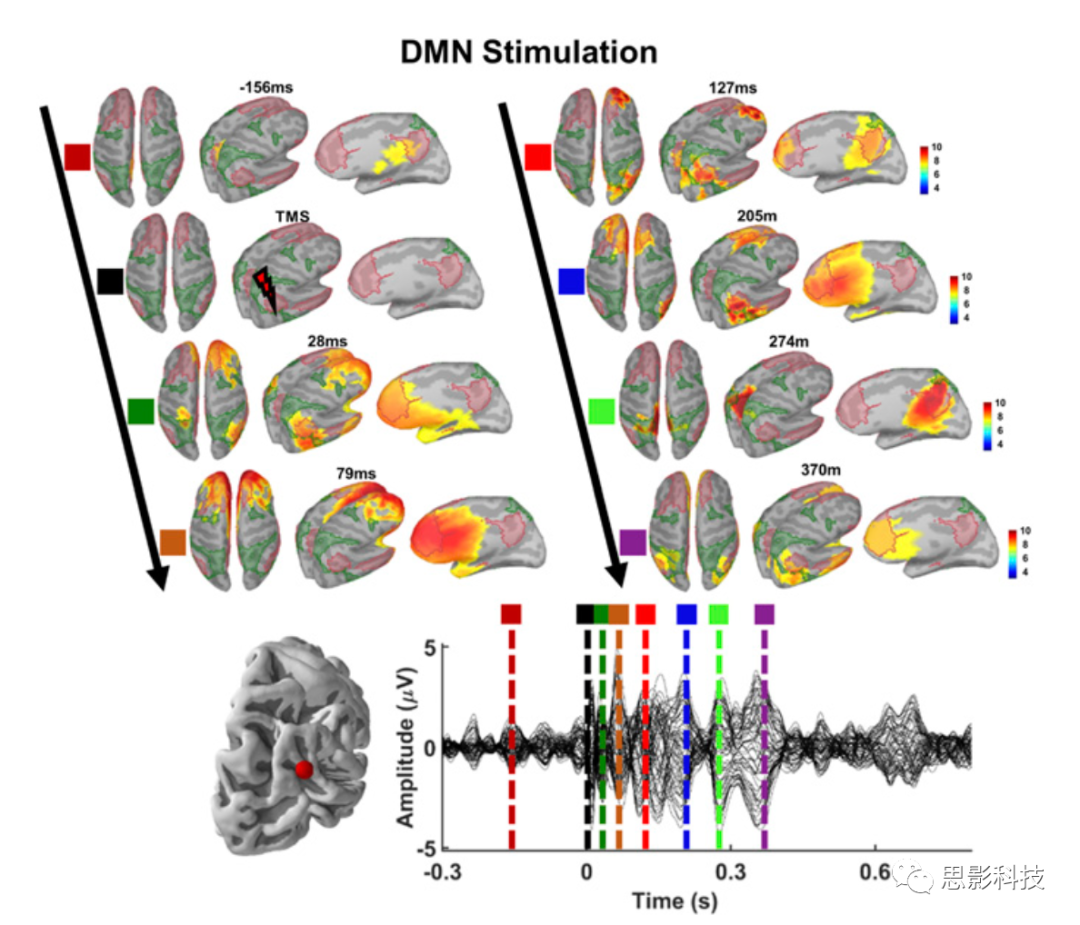
图3 TMS后DMN的激活模式
首先对平均电流密度进行了时频分析。图4提供了网络激活的时频响应和传播以及组级别的统计信息。结果表明,TMS刺激后的早期激活(30ms到150ms)具有从θ(4 Hz)到低伽马(∼30 Hz)频段的宽带振荡特征,但诱发的显著反应主要在β波段(13 Hz到30 Hz) (图4A)。具体地说,虽然在刺激条件下在两个网络中都存在β响应,但仅在受刺激的网络内观察到显著的β振荡,这表明TMS在受刺激的网络的“固有频率”上诱发了显著的网络激活。至于激活的时间传播,我们在TMS后观察到明显的相互作用模式,即与DMN相比,刺激顶上回引起DAN更高的皮层激活,而刺激角回则导致DMN激活更高(P=0.01)。此外,为了调查个体网络是否会显著影响观察到的传播模式,我们还使用基于个体fMRI种子点分析产生的网络进行了相同的分析,观察到了类似的显著交互模式 (P=0.025),不同条件下,受刺激网络的激活程度高于未受刺激的网络(SI附录图S4)。
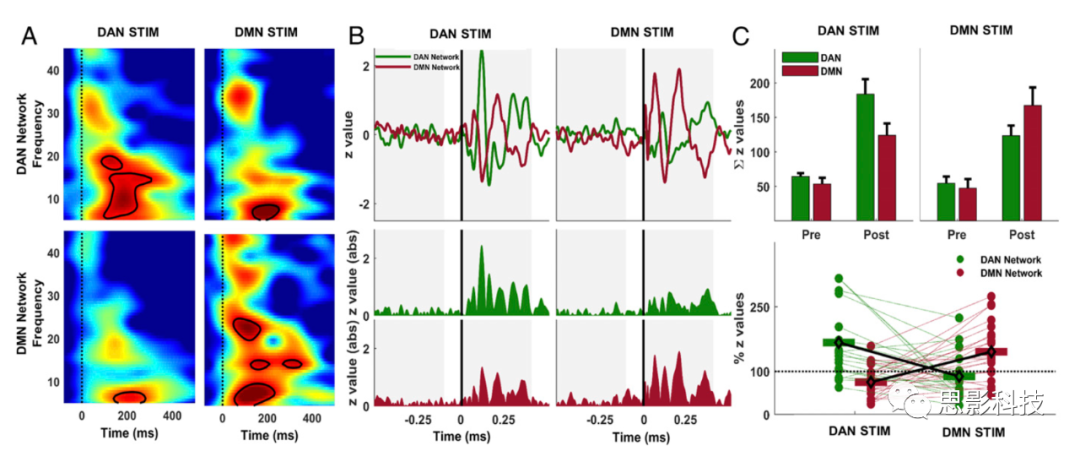
图4 网络激活的时频响应和传播
为了进一步研究网络差异和刺激条件间交互模式的时间演变,对源处的激活值以及代表DMN和DAN激活差异的个体时间序列,计算基于集群的置换配对T检验统计分析 (n=1000) (图5)。结果发现在刺激DAN后约80ms和200ms,DAN的活动显著增加。虽然DMN刺激后,DMN的时间序列高于DAN时间序列 (100ms左右有显著差异),但校正后没有显著差异(图5A右)。对于DMN−DAN交互模式,计算了所有被试(n=21)在不同刺激条件下的源处激活值的差异,即以DAN为参考,从每个被试的DMN时间序列中减去DAN时间序列,得到平均网络差异时间序列。我们发现在80-120ms,160-180ms,205-250ms有显著差异 (图5B)。最后,当观测到网络差异时,计算基于顶点的组平均差异,以进一步检查不同时间窗的激活图 (图5C)。
100ms左右的时间窗中,与刺激DMN所诱发的活动相比,DAN右侧顶叶的激活程度更高,而DMN右侧颞下的激活程度则显著降低。
约180ms时,刺激DAN使DMN右侧颞下和右额的激活程度降低。
230ms左右的时间窗中,刺激DAN导致DMN右侧顶叶的激活程度降低。
280ms时,DAN的右侧顶叶激活增强,DMN的右侧颞叶激活减弱,表明DMN和DAN节点之间的时空分离随刺激部位的变化而变化。
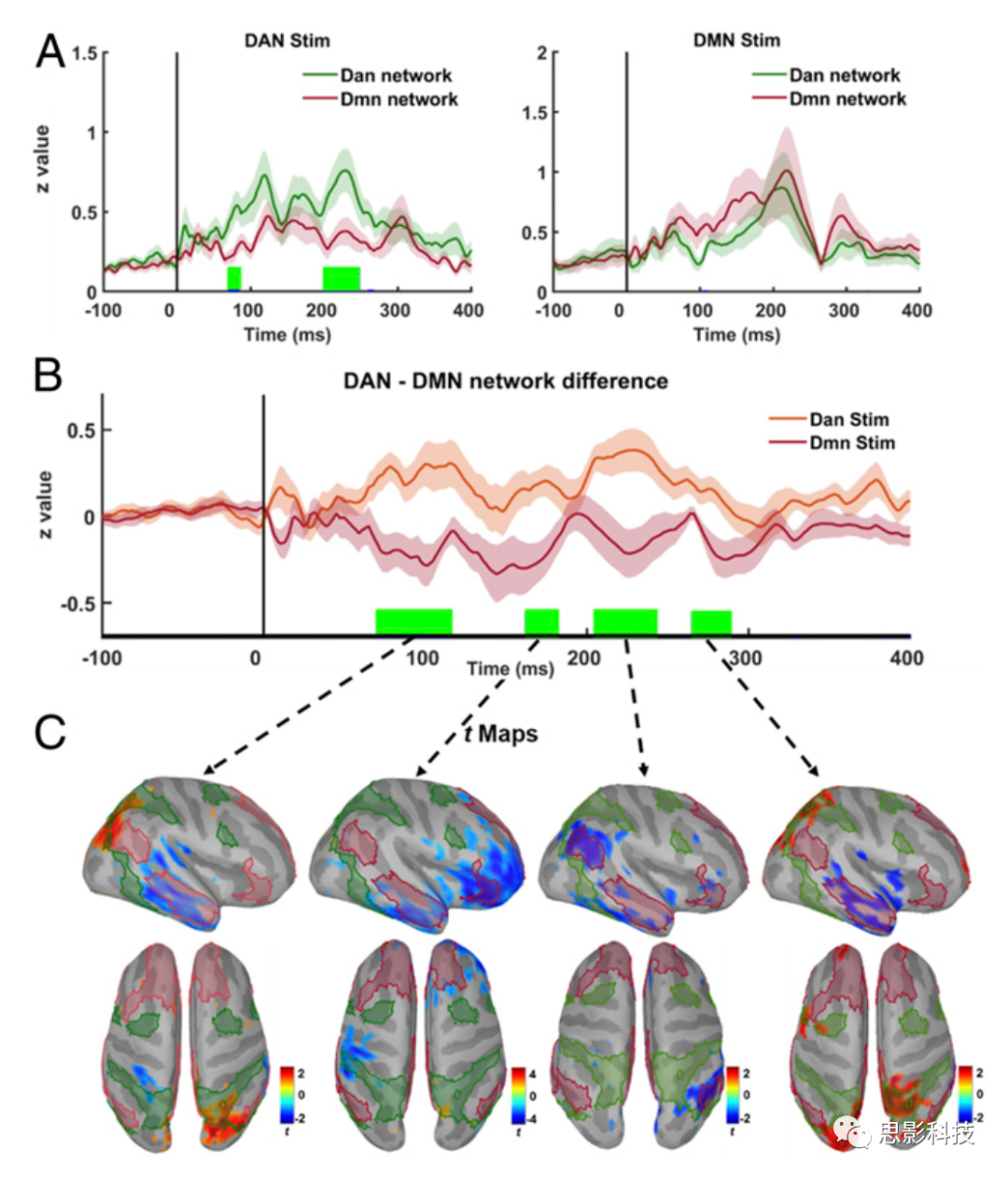
图5 TMS诱发的网络交互作用的动态变化
以网络为靶点的TMS诱导的皮质响应具有重复性
相隔1个月进行两个相同的TMS实验,能够在源水平上复现特定网络的时空动态变化。第二次实验的结果显示,与非刺激网络相比,刺激网络中的诱发活动增加了,保留了显著的交互模式(P=0.02)(图6)。结果进一步证实,TMS刺激某一节点,可以诱发特定网络的激活。两次实验在重复测量方差分析中没有发现显著差异 (P>0.05)。此外,对电极进行相关分析,进一步证实TEP在整个头皮上的可重复性。结果发现刺激条件内的头皮激活高度重叠 (第一次和第二次实验的DAN刺激),但不同刺激条件(即DAN与DMN)之间的激活截然不同,证实了结果可复现 (SI附录图S5)。
TMS诱发的特定网络激活与认知表现相关
假设之一是,TMS后网络分离(DMN/DAN)的大小与认知的个体差异有关。使用网络特异性指标(网络参与特异性[NES]) 量化TMS诱发的活动在目标网络内的传播情况。考虑到之前关于认知特征与RSNs动态、网络效率和网络间相互作用的研究,我们的目标是研究TMS网络水平响应的特异性(刺激网络的高激活与非刺激网络的参与减少)是否与认知的个体差异性有关。较高的NES值反映了更特定的TMS诱发的皮层动态活动,可能捕捉到与分离/整合相关的大脑拓扑属性。
图7A、B提供了具有高NES分数和低NES分数的被试在选定TEP峰值处的激活模式。NES值和智商得分之间存在显著的正相关 (图7C右,绿色散点:r=0.53,P=0.02),表明在刺激网络中活动较高,但在非刺激网络中相对较低的个体表现出更好的整体认知表现。还观察到流体智力评分与NES之间正相关,但无显著性 (图7C左蓝色散点:r=0.4,P=0.11;红色散点:r=0.33,P=0.17)。值得注意的是,未观察到NES与连续反应时间任务之间的显著相关性(r=0.0 1,P=0.99),表明DMN−DAN与高阶认知能力的关系似乎比与运动/感觉能力的关系更为紧密。此外,作为控制条件,我们还计算了静息态(−500到−100)皮层激活的NES值,并检查了静息态NES值和认知表现之间的相关性(图7C,黑色散点)。静息态脑电NES值与流体智力(逻辑:r=0.29,P=0.21;关系:r=0.04,P=0.80)和智商得分(r=−0.02,P=0.84)的相关性较差。
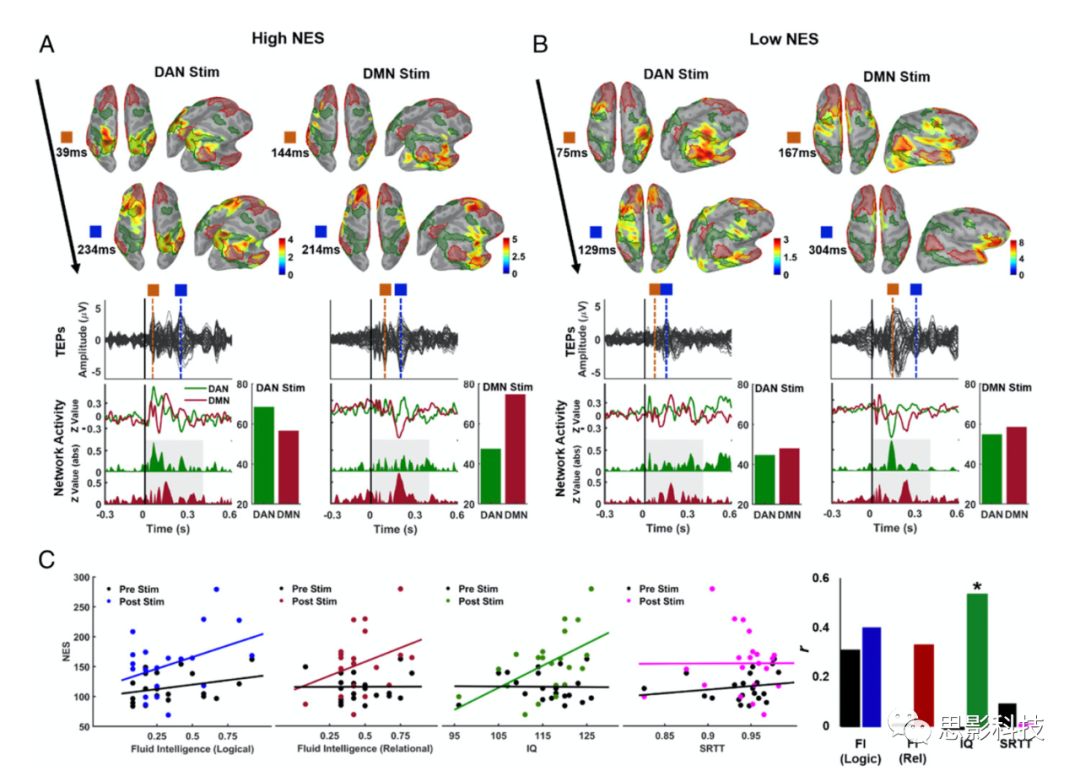
图7 TMS诱发的网络激活与认知表现的关系
讨论
在这里,我们使用fMRI引导的单脉冲TMS在DMN和DAN的顶叶节点诱发可控的扰动,并捕捉电生理信号高时间和空间分辨率的快速变化。使用功能网络图作为感兴趣区(ROI)重建单个源空间的EEG响应动态变化。我们发现,与DAN相比,靶向刺激DMN节点会导致DMN更大的激活,而刺激DAN则会导致相反的模式。值得注意的是,这种激活差异不仅局限于刺激点,会随着时间扩散且依赖于网络的拓扑结构(图5)。结果表明TMS诱发的活动会传播到同一网络具有功能连接的远端区域,显示了TMS在静息态fMRI网络中的局部和分布效应。至关重要的是,相隔1个月的实验结果可高度复现。此外,我们还提供了初步证据表明,认知能力与TMS诱导的网络激活的相关性比与静息态EEG动力学的相关性更强。总体而言,结果揭示了几个发现,对未来的研究具有参考意义。首先,通过TMS对RSNs活动的直接外部操作,结合使用EEG高时间分辨率成像,可以提供关于大脑网络之间快速、毫秒级的交互作用,这些模式是通过功能磁共振成像或静息状态EEG无法观察到的。在给定RSNs节点处施加刺激会优先在受刺激网络的其他节点内传播,并且主要在受刺激网络或脑区的固有频率处振荡调制。其次,TMS诱导的网络交互作用是可重现的,可以在不同天的实验中重复捕获,从而可以在未来网络级大脑功能障碍的临床试验中应用。最后,初步证据表明,基于扰动的传播模式有望成为人类认知能力的生理生物标志物。
TMS诱发的RSNs激活
最初,RSNs的存在首先是通过对正电子发射断层扫描的荟萃分析来确定的,正电子发射断层扫描显示,在任务执行期间,额叶和顶叶特定节点内的活动减少,被定义为DMN网络。从那时起,人类RSNs的功能结构主要通过fMRI得到BOLD信号的空间动力学来研究。由于BOLD信号的局限性,越来越多的研究采用多模态神经成像技术来理解RSNs的神经起源和空间−时间特征。fMRI-EEG研究也为RSNs的电生理学基础提供了相当多证据,证明了脑电源空间中的空间相干映射与基于fMRI的RSNs非常相似。然而,研究结果并不一致。在早期的一份报告中,研究者将独立分量分析(ICA)识别的多个RSNs的时间进程与EEG功率谱进行比较,揭示了几乎所有频段的EEG振荡与大部分RSNs活动具有相关性,表明BOLD活动与毫秒级EEG活动之间存在联系。然而,其他研究报告的相关性很弱或没有,甚至是相反的相关性。因此,EEG功率谱特征与RSNs内或RSNs间的动态功能连接之间的相关性及方向性尚未达成共识。限制了对RSNs间的因果关系或功能相互作用的理解。因此,最近的许多研究强调跳出静息态相关性研究,并建议利用直接外部操作来更好地推断RSNs之间的因果交互作用。
在这里,作者使用了一种网络扰动的方法,发现,两个在解剖上相对接近的皮层节点(即都位于右顶叶)的TMS产生了空间上不同的激活模式,并且TMS诱导的皮层电位不仅局部于刺激的网络节点内,而且优先地随着同一网络的拓扑结构和其主要振荡频率而传播。这些结果与先前的TMS-EEG和TMS-fMRI研究表明TMS诱导的活动传播到刺激部位之外是一致的。
早期的TMS-EEG研究主要集中在运动系统上,显示TMS后的局灶性反应迅速扩散到邻近的同侧运动区,随后传播到对侧运动区,可能是通过胼胝体连接。测量以非运动网络为靶点的TMS刺激前后fMRI连通性的改变,也报告了对局部和远程网络节点激活的调制。最近,有报道称对神经外科患者不同的RSNs节点进行颅内电刺激,由侵入性刺激诱发的反应在RSNs间相互传播。我们的数据扩展了这些结果,提供了以下可能的证据:
1) 两个相邻皮层节点受到非侵入扰动后具有靶向参与性;
2)以毫秒级的分辨率可以捕捉到它们的响应,诱发了基于fMRI网络内的局部和分布式皮层传播模式。以前的研究表明了从网络的角度看待脑刺激的临床和治疗价值,促进基于神经导航的实验性扰动,以更好地理解各种精神和神经疾病的症状学潜在的异常网络及网络的相互作用。与这些概念一致,本文的发现支持基于扰动的非侵入性神经成像作为一种可行和可靠的多模态工具来参与和表征人脑的网络级反应。
网络参与的重现性
TEP(TMS诱发电位)包含丰富的神经生理学信息,因此可以直接测量皮层生理特性(如兴奋性、抑制性和连通性)的瞬时和持久变化。此外,到目前为止,TEP在健康和临床人群中具有个体差异,尽管组平均TEP的可靠性已经在电极水平上进行了测量,但还没有研究在网络水平上使用RSNs作为源空间中的ROI来评估TMS诱发激活的重复性。在这里,通过为每个被试进行两个相隔1个月的相同实验,表明单个TEP的源重建对于DAN和DMN都是高度可复现的(图5)。
关于TMS诱发的EEG反应中是否存在稳定的非经颅外周成分仍存在争议,是限制TEP解释和应用的一个主要因素。虽然本研究结果的有效性和可靠性可能会受到诸如体感和听觉电位等外周诱发反应的影响。有几条证据表明我们的发现反映了经颅诱发的皮层活动。
首先,作者了遵循最先进的程序来最小化体感诱发电位和听觉诱发电位(AEPs),在线圈下面放置一层泡沫层,并屏蔽听觉噪音。
其次,应用两步ICA,首先去除特定于TMS的伪影,同时去除剩余的肌肉、电极和心电伪影 (SI附录,图S1)。第二次ICA中,只有5名被试清晰地出现了AEPs,表明屏蔽噪声可以有效抑制非特异性的TMS诱导的听觉激活。
第三,源分析显示了TMS在刺激网络中诱导激活的特异性,表明数据没有受到体感或听觉电位的干扰。最后,我们的地形可靠性分析(SI附录,图S5)在单电极水平上,也与源水平的网络激活相一致,显示了DAN和DMN的TMS的地形学特异性。值得注意的是,体感诱发电位主要分布在刺激部位对侧的躯体感觉皮层,而AEPs则分布在双侧颞上叶,与刺激部位无关。体感诱发电位或AEPs的存在会导致刺激部位之间相对一致的激活模式。然而,我们发现在刺激DMN后600ms的DMN特异性前额叶区域有更高的激活,而DAN刺激没有这种激活,这表明地形图具有特异性。
TMS诱发的网络活动的特异性与认知相关
大多数研究都集中在对静息态下获得的数据进行建模,在一定程度上表明,可以用来预测个体在几个认知功能、人格特征和行为方面的差异。然而,最近的证据表明,基于任务的神经成像可以更好地描述个体连接模式和认知能力之间的联系。与静息态的fMRI模型相比,建立在任务fMRI上的模型在预测流体智力方面表现更好,这表明基于任务的设计可能会沿着特定的认知维度“扰乱”大脑,从而提供机会来识别大脑连接个体模式的细微差异。尽管TMS最初扰乱局部节点,但是诱导活动随时间跨脑区传播,且传播节点具有功能连通性。我们的分析表明,网络激活的特异性与流体/晶体的认知能力之间存在显著的正相关,表明受到扰动后,网络内和网络间的活动可能构成人类认知能力的生物标志物(优于静息状态脑电数据)。
更具体地说,本文发现TMS在DMN和DAN之间诱导了相反的振荡模式,这种模式对优化认知功能至关重要,是自适应地在自我参照任务和外部定向任务之间引导注意资源的基础。有趣的是,与目前的结果一致,我们小组最近的一份报告显示:1)在流体智力(Gf)任务时,具有强大协同激活能力的脑区与DAN高度重叠,更重要的是,这些区域与DMN之间负相关的强度是个体流体智力(Gf)表现的重要预测因子。这表明,以网络为靶点的TMS-EEG能够捕捉到相同的fMRI动态变化,但具有高的时间分辨率,证明负相关潜在的本质。最后,我们发现网络参与与控制运动学习任务的表现不相关,这表明诱发的大脑皮层网络动力学和认知之间的关系不是一个一般性和非特异性的发现。未来的研究需要对人类认知的自发的、基于任务的和基于扰动的神经标记物进行系统的全面调查。
本研究的局限性和未来发展方向
尽管EEG响应的源定位显示了传播模式取决于被刺激的网络,但将TMS-EEG与fMRI相结合将在空间上更精准地捕捉TMS诱发的网络效应。另一个重要的考虑是需要用相关的任务设计来扩展当前的网络扰动方法,以便在刺激期间控制大脑状态。鉴于DAN和DMN在静止和认知过程中的动态和相互联系,有必要考察:1)在任务执行过程中,TMS诱发的网络内和网络间的激活在多大程度上与任务激活重叠;2)TMS诱导的网络动力学能否预测健康人和神经/精神疾病人的任务表现。
总结
本文使用TMS直接对靶点脑区进行外部干扰,同时使用EEG检测电生理信号,在高时间和空间分辨率下,提供了关于脑网络之间快速演变以及相互作用的证据,并且证明了其与认知表现的相关性,这些是通过低时间分辨率的fMRI或低空间分辨率的静息态的EEG无法观察到的。
由于部分患者的任务参与能力较差,本文的方法是一种很好的替代措施,可以更清楚的了解脑区之间的信息传递模式,在临床上应用也可以更好地理解病理并确定治疗靶点。本文的数据采集过程以及预处理过程十分严谨,尽可能避免一切干扰,从大脑到行为表现的研究思路也很完善,值得为我们学习,也许小小的遗憾是EEG的数据分析过程均为离线解析,如果搭配上实时EEG处理,在临床应用上可能会实现更大的突破。

微信扫码或者长按选择识别关注思影
如对思影课程感兴趣也可微信号siyingyxf或18983979082咨询。觉得有帮助,给个转发,或许身边的朋友正需要。请直接点击下文文字即可浏览思影科技其他课程及数据处理服务,欢迎报名与咨询,目前全部课程均开放报名,报名后我们会第一时间联系,并保留名额。
更新通知:第十届脑影像机器学习班(已确定)
磁共振脑影像结构班(预报名)
弥散磁共振成像数据处理提高班(预报名)
小动物磁共振脑影像数据处理班(预报名)
更新通知:第二十届脑电数据处理中级班(已确定)
脑电信号数据处理提高班(预报名)
眼动数据处理班(预报名)
近红外脑功能数据处理班(预报名)
数据处理业务介绍:
招聘及产品:
招聘:脑影像数据处理工程师(重庆&南京)