异柠檬酸脱氢酶(Isocitrate dehydrogenase, IDH)突变状态已成为神经胶质瘤的重要预后标志。当前,可靠的IDH突变诊断需要侵入性外科手术。该研究的目的是使用T2加权(T2w)MR图像开发高度精确的、基于MRI的、基于体素的深度学习IDH分类网络,并将其性能与基于多模态数据的网络进行比较。研究人员从癌症影像档案馆(The Cancer Imaging Archive,TCIA)和癌症基因组图谱(The Cancer Genome Atlas,TCGA)中获得了214位受试者(94位IDH突变,120位IDH野生型)的多参数脑MRI数据和相应的基因组信息。他们开发了两个单独的网络,其中包括一个仅使用T2w图像的网络(T2-net)和一个使用多模态数据(T2w,磁共振成像液体衰减反转恢复序列(FLAIR)和T1 postcontrast)的网络(TS-net),以执行IDH分类任务和同时进行单标签肿瘤分割任务。本文使用3D的Dense-UNets的架构。使用三折交叉验证泛化网络的性能。同时使用Dice系数评估算法分割肿瘤的精度。T2-net在预测IDH突变状态任务上表现出97.14%±0.04的平均交叉验证准确率,灵敏度为0.97±0.03,特异性为0.98±0.01,曲线下面积(AUC)为0.98±0.01。TS-net的平均交叉验证准确性为97.12%±0.09,灵敏度为0.98±0.02,特异性为0.97±0.001,AUC为0.99±0.01。T2-net的肿瘤分割Dice系数的平均得分为0.85±0.009,TS-net的肿瘤分割Dice系数的平均得分为0.89±0.006。
介绍
异柠檬酸脱氢酶(IDH)突变状态已成为神经胶质瘤诊断和治疗的最重要标志之一。具有这种突变酶的神经胶质瘤的预后要好于野生型IDH的相同等级的肿瘤。这一发现促使世界卫生组织在2016年修改了其对神经胶质瘤的分类。IDH突变型的肿瘤与野生型的肿瘤相比,也有不同的处理和治疗方法。目前,确定IDH突变型胶质瘤的唯一方法是对通过活检或手术切除获得的组织标本进行免疫组织化学(IHC)或基因测序。由于IDH突变型和IDH野生型胶质瘤之间的差异可能具有重要的治疗意义,因此在手术前尝试区分这两种肿瘤类型很有意义。对于可能存在严重的术后并发症和具有高风险的损伤而无法进行活检或切除的脑肿瘤患者而言,这一点变得更加重要。
核磁共振波谱可以用来确定IDH突变状态。突变的IDH酶催化合成2-羟基戊二酸酯(2-HG)。目前已经开发出MR波谱法用于无创地鉴定脑肿瘤中的2-HG。尽管这些方法在研究环境中似乎效果很好,但在繁忙的临床环境中,由于存在伪影、患者头动、匀场不良、体素小、肿瘤位置不理想或存在出血或钙化等现象,波谱成像数据经常无法很好的解释。即使在设置高质量波谱的情况下,使用2-HG波谱学的可靠临床实施方法也得到了进一步证实,这种方法的误报率也达到了20%以上。
对IDH突变状态的早期诊断将直接影响治疗方案。表现为低级别(low-grade)胶质瘤但实际上是IDH野生型的肿瘤通常采用早期干预而非观察治疗。特异性化疗干预对IDH突变型的胶质瘤更有效(如替莫唑胺)。此外,已证明在III–IV级IDH突变型的肿瘤中,非增强肿瘤体积的手术切除(超出了增强肿瘤成分的总切除量)具有生存优势。然而,IDH突变状态的测定仍然采用直接组织取样的方法。获取富含肿瘤的组织样本来确定IDH状态可能是一个挑战。一份来自癌症基因组图谱(The Cancer Genome Atlas, TCGA)的报告显示,只有35%的活检样本含有足够的肿瘤成分,可以进行适当的分子表征。开发一种可靠的非侵入性方法将有利于这些患者的护理。
在基于MRI的肿瘤遗传和分子生物的预测任务上,深度学习方法优于传统的机器学习方法。例如,Zhang等人使用了一种结合基于支持向量机的模型和多模态MRI特征的放射组学方法来检测IDH,准确率达到80%。在另一项使用多模态MRI、临床特征和随机森林机器学习算法的研究中,在预测IDH突变状态的任务上,Zhang等人得到了86%的准确率。在该研究中,表现最好的预测特征包括年龄、参数强度、纹理和形状等特征。在Chang等人最近的研究中,他们通过使用基于MRI的深度学习算法,非侵入性地确定IDH突变状态,在肿瘤影像档案(TCIA)数据库上的准确率为94%。遗憾的是,这些方法在临床上都不可行,要么需要对肿瘤进行人工预分割,要么需要大量的预处理步骤,要么就是为了获取多模态影像需要长时间的扫描而因此会受到患者头动的影响。此外,现有的方法是基于2D影像的分类方法,即基于切片(slice-based)的方法。基于切片的方法存在一个问题——即数据泄漏的问题。使用横断面成像数据的2D切片模型尤其容易出现数据泄漏,因为它们对所有被试的3D影像进行随机切片,然后生成训练、验证和测试切片数据。因此,来自同一被试的相邻切片可以在训练、验证或测试数据子集中找到。由于相邻的切片通常共享相当多的信息,因此这种方法可能通过在测试阶段引入偏差来人为地提高准确率。先前报道的研究似乎没有遵循这一警告,这可能导致人为地提高准确性。
本研究的目的是开发一个仅使用T2加权(T2w)图像的具有较高分类精度的全自动IDH分类3D网络,并将其性能与使用多模态数据的3D网络进行比较。仅使用T2w图像将提供强大的临床转换能力。在任何MRI脑肿瘤评估策略中,都会采集T2w图像。这些图像对患者头动具有鲁棒性,可以在2分钟内获得。在大多数临床环境中都可以使用的现代MRI扫描仪上,即使患者头动剧烈,也可以通过使用常见的运动阻尼采集技术获得高质量的T2w图像。
数据和方法
数据及预处理
神经胶质瘤患者的多参数脑MRI数据来源于TCIA数据库。基因组信息由TCGA数据库提供。研究筛选了可用的IDH状态数据以及T2w、T2w-FLAIR和对比度增强的T1w(T1c)影像序列。最后的数据集包括214个被试 (94个IDH突变型,120个IDH野生型)。TCGA被试的IDs、IDH突变状态、1p/19q共同缺失状态、组织学、临床变量(包括年龄、性别、生存时间、Karnofsky表现评分)列在补充表1中。这批数据队列中患者的平均年龄为52±15岁,其中48%为女性。组织学上,49%的肿瘤为胶质母细胞瘤,22%为少突胶质母细胞瘤,15%为星形细胞瘤,14%为少突星形细胞瘤,其中,IV级肿瘤占48%,III级肿瘤占27%,II级肿瘤占24%。在这个队列中,有56%的肿瘤是IDH野生型,有42%是IDH1突变型,有1.9%是IDH2突变型。由于绝大多数IDH突变是IDH1,因此IDH1和IDH2突变体都被视为一组。86%的IDH突变病例没有1p / 19q编码,而14%的病例有。利用Sanger测序方法和全基因组扩增DNA外显子组测序,确定TCGA中IDH突变状态。桑格法(Sanger method)被认为是遗传分析的金标准。
87名被试的肿瘤分割可通过先前的专家分割获得。其余127名被试的肿瘤分割是由内部的神经放射学家手工绘制和验证的。在训练步骤中,使用手工分割作为肿瘤分割算法的ground truth。在ground truth中,IDH突变型肿瘤被标记为1,IDH野生型被标记为2(图1)。预处理步骤包括:
(1)使用N4矫正算法用来消除射频不均匀性;
(2)将多模态数据重配准到T1c像上(仅适用于TS-net);
(3)将图像强度归一化为零均值和单位方差。使用Advanced Normalization Tools (ANTs)软件处理数据,每个数据耗时不到5min。
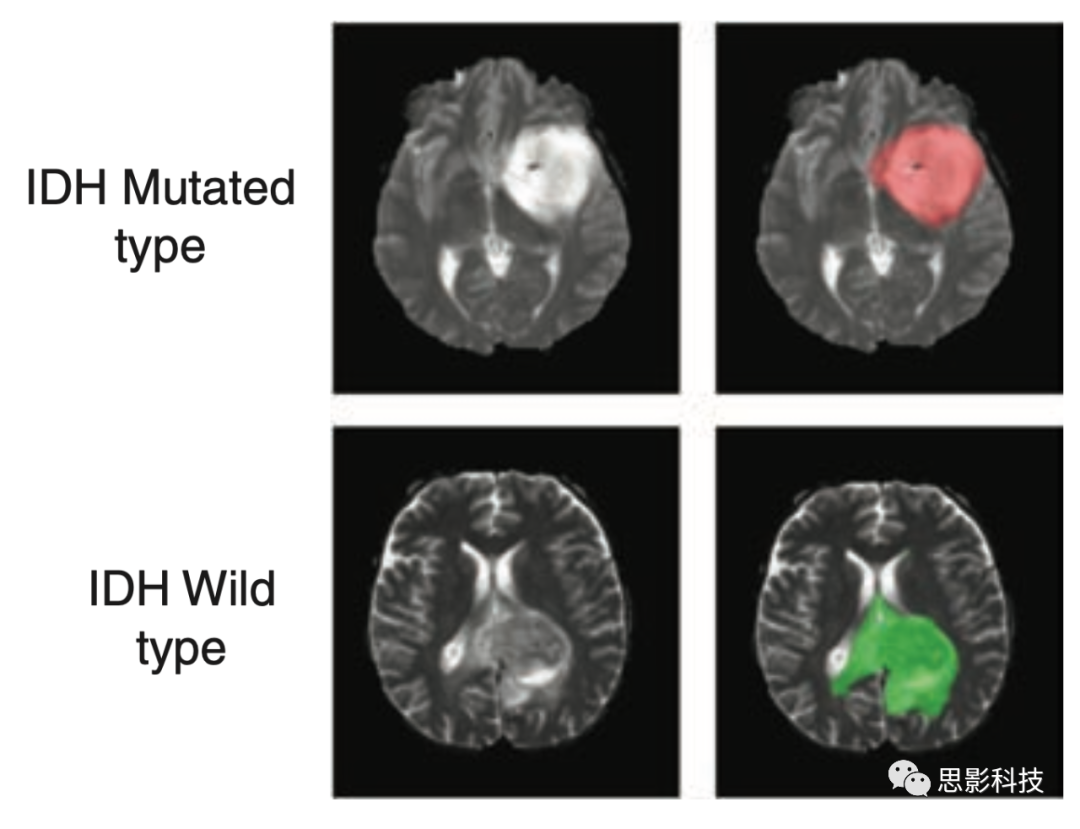
图1 肿瘤分割精标准。红色体素代表IDH突变型(标签值1),绿色体素代表IDH野生型(标签值2)。每个肿瘤中所有体素的ground truth标签都具有相同的突变状态。
网络细节
开发了两个独立的网络,其中包括一个仅在T2w图像上训练的T2-net网络(图2A)和一个在多模态MR数据(包括T2w图像、T2-FLAIR图像和T1c图像)上训练的TS-net网络。两种网络都采用了基于3D 32×32×32 patch的训练和测试方法。研究人员设计并训练了Dense-Unets来进行在整个肿瘤上的基于体素的两类分割,其中1代表IDH突变型,2代表IDH野生型。网络架构示意图如图2B所示。每个网络由7个dense block组成:3个transition down block,3个transition up block,1个用于初始化的卷积层,在网络的最后再接上1个卷积层和1个函数激活层。每个dense block由5层layer组成。每一层layer都与那个dense block中的每一层layer相连。这种密集连接是通过将来自一层的特征映射与来自该密集块的每一层的特征映射连接起来实现的。Dense block的输入也连接到该dense block的输出。在网络的编码器部分的每个dense block之后是一个transition down block,而在网络的解码器部分的每个dense block之前是一个transition up block。Bottleneck块用于减少卷积层中特征图的通道数量,以避免出现较大的卷积层。有了这些关联模式,所有的特征图都被重用了,这样架构中的每一层都收到了直接的监控信号,具体细节见图3。
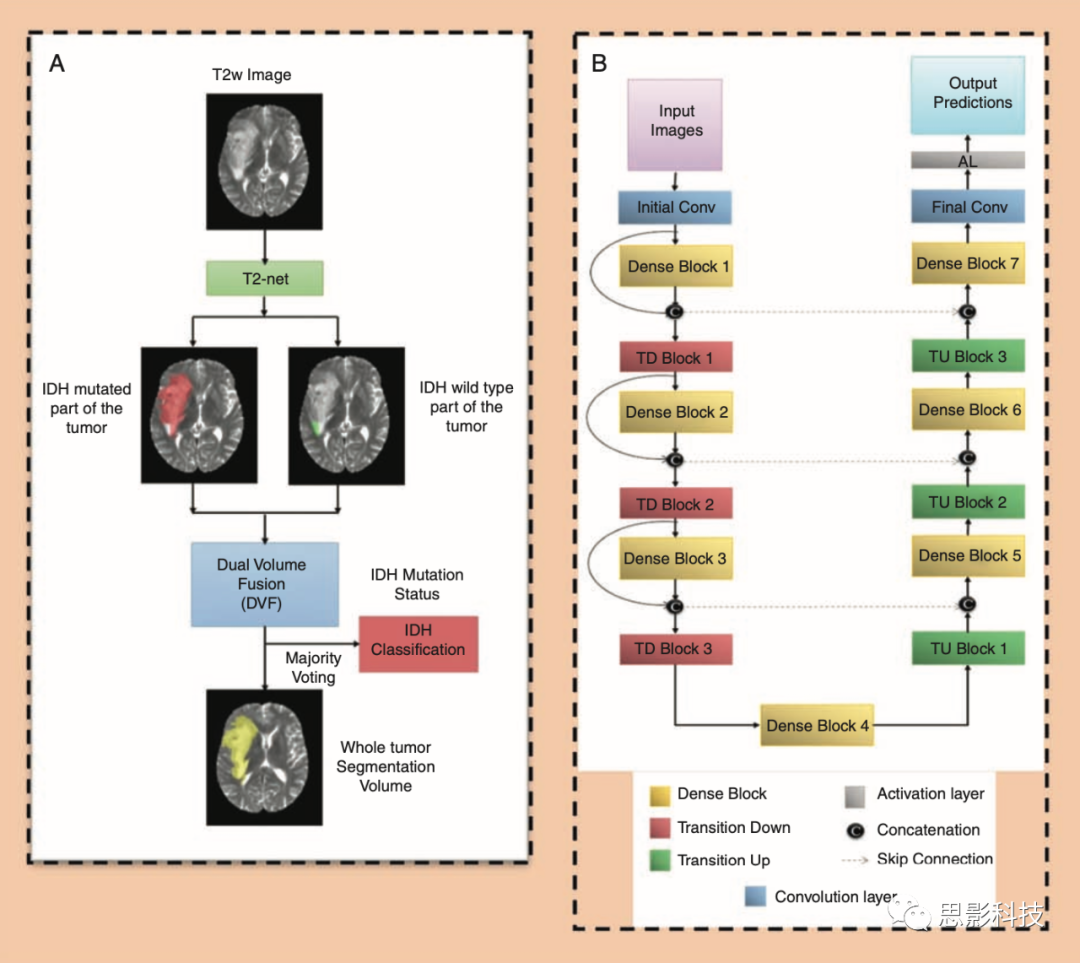
图2 (A)对IDH突变状态进行体素级别的分类,分别生成两个volume(一个volume标记了IDH突变型的体素,另一个volume标记了IDH野生型的体素)。将这两个Volume使用dual volume method融合起来以消除假阳性并生成肿瘤分割结果。同时在所有体素上使用多数投票(majority voting)的方法来决定整个volume的IDH突变状态。
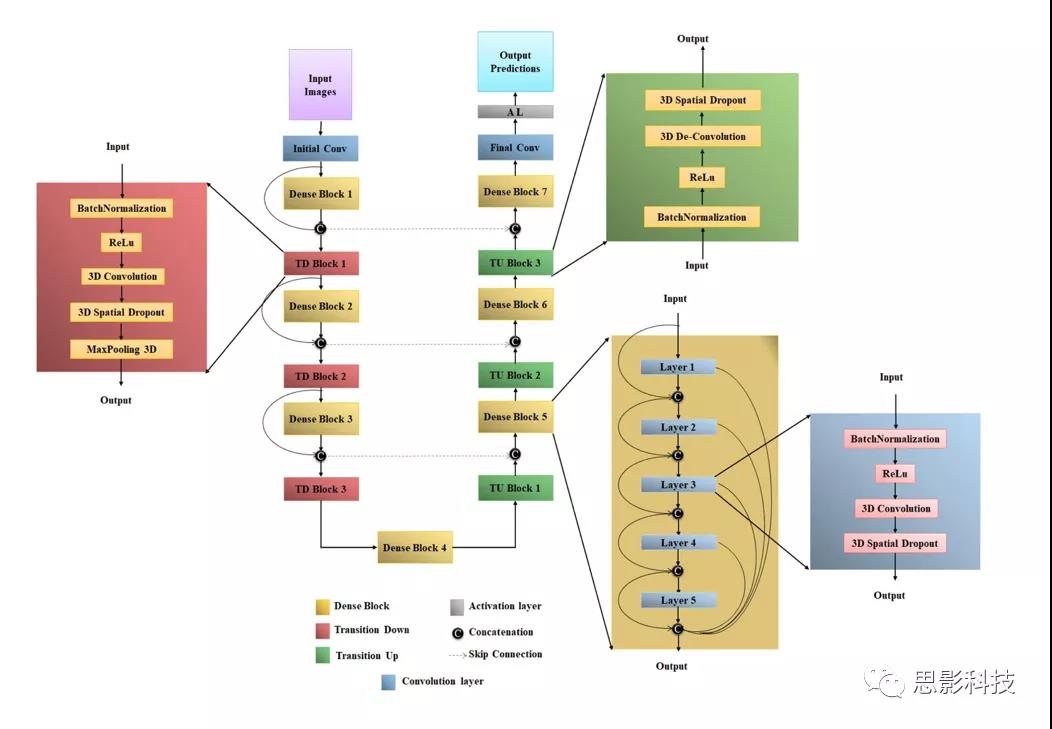
图3 Dense-UNet详解。
(a)BatchNormalization层先对前一层传来的特征层归一化处理,然后乘以缩放参数并加上偏置参数。BatchNormalization用来解决深层神经网络中常常出现的Internal Covariate Shift问题,用来加速网络收敛并提升网络的泛化性能;
(b)(b)ReLU函数是深度学习中最常用一种激活函数,通常使用非线性的激活函数使神经网络具有非线性用以拟合分布复杂的数据,ReLU(x)=max(0, x);
(c)Spatial Dropout是Dropout的一种变体,Dropout层在每次训练过程中随机丢失部分网络参数,但是在推理阶段会保留所有网络参数,这样相当于隐式地对网络进行了集成,提高了网络的泛化性能;
(d)MaxPooling是一种下采样技术,在一定窗口大小下的特征图取其最大值实现下采样;
(e)Dense Block是2017年提出的一种网络架构(详见Huang G, Liu Z, Der Maaten L V, et al. Densely Connected Convolutional Networks[C]. computer vision and pattern recognition, 2017: 2261-2269.),通过连接模块内的所有特征图实现特征的复用,提高特征使用效率;
(f)Transition down模块用于实现特征图的下采样,实现高级语义特征的提取;
(g)Transition up模块用于对低分辨率的特征图进行上采样,用于恢复图像尺寸,同时对高级语义特征进行解码;
(h)Skip Connection用于连接编码器和解码器处的多尺度特征。
网络实现与交叉验证
为了提高网络的泛化性能,对214名被试数据进行了3折交叉验证,方法是将数据集随机打乱,并将其分为3组(每组约70名受试者)。在交叉验证过程的每个阶段,这三组分别在训练、训练中验证和测试中进行。1组72例 (IDH突变型32例,IDH野生型40例),2组71例 (IDH突变型31例,IDH野生型40例),3组71例 (IDH突变型31例,IDH野生型40例)。训练中的验证集有助于提高训练期间的网络性能。请注意,交叉验证过程的每一步都代表了针对这三个组的独特组合的一个新的训练阶段。然而,网络性能只在每一折的测试组上报告(测试组在这一折的算法训练阶段中从未见过)。补充表1列出了交叉验证的每个折叠的组成员。算法使用训练中的验证数据集来测试每一轮训练后的性能,并更新模型参数。算法根据来自训练中的验证数据集的每一轮结果调整其性能。一旦算法完成了所有的训练,它将在真实的数据集上进行评估,以确定性能。为避免数据泄漏问题,没有将来自同一被试数据的patch与训练集、验证集或测试集混合在一起。数据增加的步骤包括水平翻转、垂直翻转、随机旋转和平移旋转(通常会做一些数据扩增提高网络的泛化性能)。数据扩充总共提供了大约150000个训练patch和150000个验证patch。使用Keras和Tensorflow实现网络,使用Adam优化器对模型参数进行优化。初始学习速率设置为10−5,批处理大小为4,最大迭代次数为100次。初始参数的选择是基于之前使用脑成像数据和语义分割(语义分割可以理解为像素级别的分类任务,通过对图像上的每个像素点分类到达图像分割的目的)的Dense-UNet的工作。
每个网络产生2个分割结果。Volume 1是IDH突变型肿瘤的体素级别的预测结果,Volume 2是IDH野生型肿瘤的体素级别的预测结果。研究人员提出了一种简单的双volume融合(dual-volume fusion,DVF)的方法来合并两个分割volume。利用MatLab中的3D连通分量算法,将这两个volume进行合并,得到最大的连通分量(由于这个算法是在体素级别上预测,所有可能存在一些独立的体素被分出来,而肿瘤一般是一个内部联通的区域,所以通过使用联通分量算法删除那些较小的联通分量,而只保留最大的联通分量来生成肿瘤分割结果)。合并的volume生成了唯一的肿瘤分割结果。通过使用多数投票的方法在体素级别上的IDH类别进行合并,为了每个被试的数据预测单一的IDH分类结果(意思就是哪一类的体素数量更多就分为哪一类)。在Tesla P100、P40和K80 NVIDIA图形处理单元(GPU)上实现了网络。
统计分析
分别在MatLab和R中对T2-net和TS-net的结果进行统计分析。2个网络的准确率通过多数投票来评估(即体素级别的概率阈值为0.5)。然后,使用该阈值计算交叉验证过程中每一折的模型的准确率、灵敏度、特异度、阳性预测值(PPV)和阴性预测值(NPV)。在每一折中计算接受者操作特征(receiver operating characteristic, ROC)曲线。使用Dice系数评估网络分割肿瘤的性能。Dice系数表征了网络分割结果与手工分割结果之间的空间重叠率。Dice系数的计算公式为:
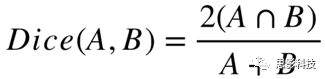
其中A和B分别为两个分割结果,这个式子表示A与B的交集中元素的数量的两倍和A与B的并集中元素的数量之间的比值。
网络将肿瘤中的体素分为IDH突变型和IDH野生型。通过将预测的IDH突变型体素除以每个肿瘤中预测体素的总数,计算每个被试的网络输出中IDH突变型体素的百分比。突变型体素的百分比可以看作是肿瘤为IDH突变型的概率。在ROC分析中,对IDH突变型体素的百分比进行排序,并作为单独的阈值(切割点)来确定在每个新的切割点中整个测试集的被试的IDH突变状态。在每个阈值下,通过将预测得到的IDH类别属性与真实值进行比较计算出灵敏度(真阳率)和 1-灵敏度(假阳率)。使用Matlab绘制结果,得到ROC曲线(真阳性率对假阳性率)。对来自T2-net和TS-net三折交叉验证中分别重复该步骤,共得到6条来自交叉验证的ROC曲线(T2-net 3条,TS-net 3条)。
结果
T2-Net T2-net在3折交叉验证中的平均测试精度为97.14%(97.18%、97.14%和97.10%,SD = 0.04)。T2-net交叉验证的平均灵敏度、特异度、PPV、NPV、AUC分别为0.97±0.03、0.98±0.01、0.98±0.01、0.97±0.01、0.98±0.01。肿瘤分割的三折交叉验证中平均Dice得分为0.85±0.009。T2-net在每一折中都错分了两例(214名被试中共6例)。其中3例被错分为IDH突变型,3例被错分为IDH野生型。
多模态TS-Net TS-Net在3折交叉验证中得到了了97.12%的平均测试精度(97.22%,97.10%,97.05%,SD = 0.09)。TS-net交叉验证的平均灵敏度、特异度、PPV、NPV、AUC分别为0.98±0.02、0.97±0.001、0.97±0.002、0.97±0.001、0.99±0.01。肿瘤分割的交叉验证中平均Dice得分为0.89±0.006。TS-net中每组也有2例分类错误(214名被试中共有6例)。其中3例被错分为IDH突变型,3例被错分为IDH野生型。TS-Net误分类的被试与T2-net误分类的被试不一致。T2-net和TS-net的分类精度和Dice得分如表1所示。
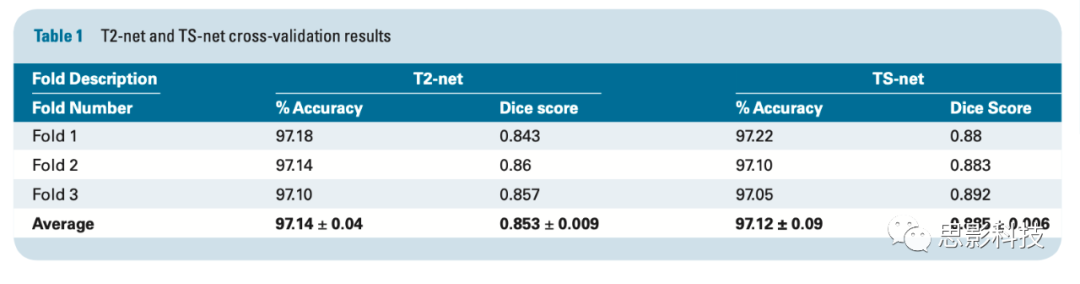
表1 T2-net与TS-net的交叉验证结果
ROC分析 图4中提供了T2-net和TS-net的每个交叉验证的ROC曲线。T2-net和TS-net表现出相似的性能曲线,都具有极高的灵敏度和特异性。
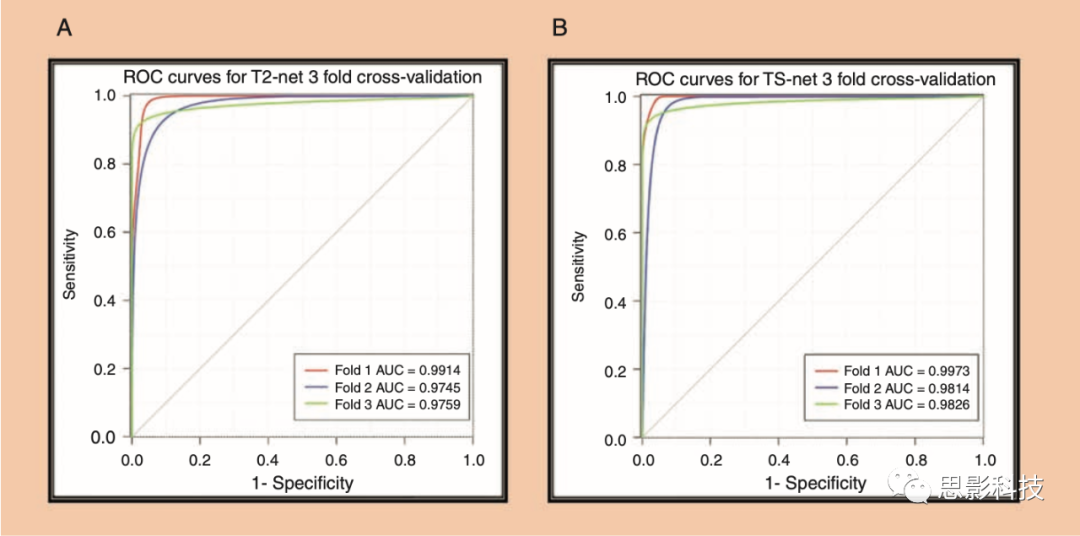
图4 (A)T2-net的ROC分析结果(B)TS-net的ROC分析结果。每个交叉验证结果都有单独的曲线和相应的AUC值。
体素级别的分类
由于这些网络是体素分类器,它们将同时进行肿瘤分割。图5A和B显示了使用T2-net的IDH野生型和IDH突变型的体素级别的分类结果。DVF程序在消除假阳性以提高准确性方面是有效的。DVF程序分别删除了大约16%和17%的T2-net和TS-net的分类体素。这个过程将每个网络的Dice系数提高了大约3%。研究人员还计算了每个网络的体素级别的准确率。两种网络在IDH野生型被试上的表现非常相似,而在IDH突变型上,TS-net的体素级别的准确率更好。T2-net中,IDH野生型的平均体素准确率为84.9%±0.05,IDH突变型的平均体素准确性为76.4%±0.03。TS-net中,IDH野生型和IDH突变型的平均体素准确率率分别为85.7%±0.04和84.7%±0.01。
训练和分割时间
每个网络大约花了2周的时间来训练。训练后的网络大约需要3分钟来分割整个肿瘤,并预测每个受试者的IDH突变状态。
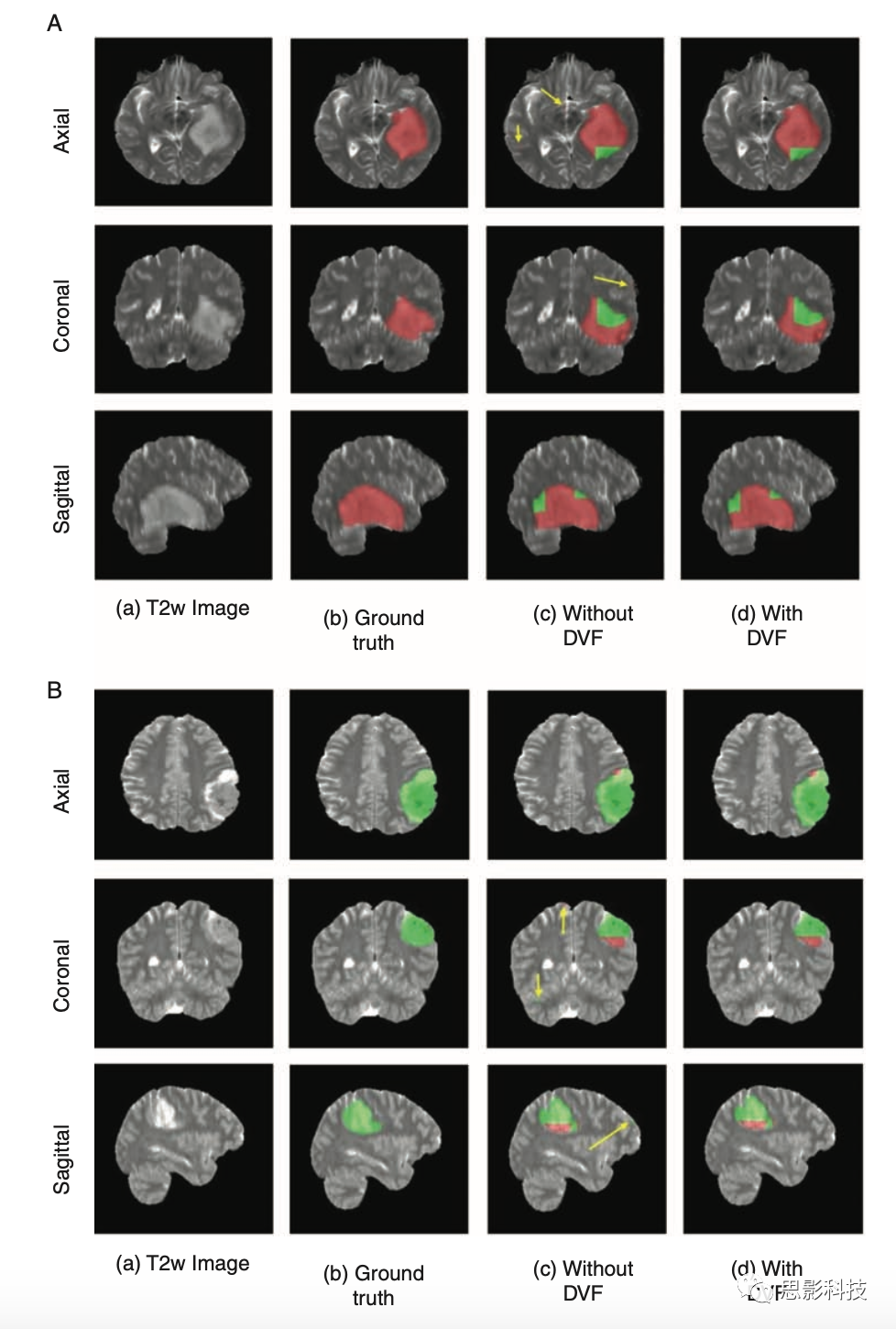
图5 (A) IDH突变肿瘤的体素级别的分割例子。(a)未经过处理的T2w图像(b)手工分割结果 (c)未经过DVF处理的网络输出 (d)经过DVF处理的网络输出。(c)中的黄色箭头表示假阳性。红色体素对应IDH突变型,绿色体素对应IDH野生型。(B)一例IDH野生型肿瘤的体素分割。
讨论
本文开发了2个仅基于影像特征的IDH分类的深度学习网络。T2-net和TS-net都优于之前文献报道的IDH分类算法。将T2-net与TS-net进行比较,结果表明,仅使用T2w图像也可以获得相似的性能。仅使用T2w图像的能力使临床转换更加简单,并且更不容易由于图像采集伪影而失败。用于准备数据的预处理也很少。在K80或P40 NVIDA GPU上,T2-net分割整个肿瘤、实现DVF、预测一个被试的IDH突变状态所需的时间约为3分钟。
有几个因素可以解释为什么本文介绍的神经网络取得了比以前发表的结果更高的性能。首先也是最重要的是使用3D网络,与之前报道的2D网络相比。此外,3D网络结构的优势在于密集的连接将信息从之前的所有层传送到下面的层。这些类型的网络更容易训练,可以减少过度拟合。DVF后处理步骤也有助于有效地消除假阳性,同时通过排除与肿瘤无关的外部体素来提高分割准确率。DVF将每个网络的Dice得分提高了大约3%。3D网络在片与片之间进行插值,以更准确地保持片间信息。这些网络使用最少的预处理,不需要从图像或组织病理学数据中提取预先设计好的特征。
此处使用的3D网络是体素级别的分类器,可为图像中的每个体素分类。这意味着可以同时进行肿瘤分割(例如,分类为IDH突变和非突变的体素之和提供了肿瘤标记)。这些网络的交叉验证使得T2-net和TS-net达到了分别为0.85和0.89的优秀的Dice评分。这些肿瘤分割Dice得分与BraTS2017肿瘤分割挑战赛的前几名选手相似。
T2-net和TS-net的分类精度基本相同。这说明仅T2w图像信息就可以提供较高的分类置信度。对于IDH野生型肿瘤,两种网络在每一折中都错误地将2例患者分类。这6个被试在不同的网络之间是不一样的。在回顾这些病例时,没有区别性的影像学特征。这些病例中大多数为异质强化、T2和FLAIR信号混杂、周围水肿。尽管T2-net和TS-net在按被试上的IDH分类上表现出相似的性能,但体素级别的性能上不同网络之间存在差异。TS-net在预测IDH野生型体素方面显示了类似的准确率(85.7%对84.9%),而在预测IDH突变型体素方面的准确性略高(84.7%对76.4%)。
由于这些网络是体素分类器,所以每个肿瘤中都有一部分属于IDH突变区,其他区域属于IDH野生型。随着时间的推移,胶质瘤中可能出现异质性基因表达,导致肿瘤生物学的多样性。在临床环境中,主要使用免疫组织化学(IHC)评估。IHC使用单克隆抗体检测最常见的IDH突变(如IDH1-R132H)。不同的阈值被提出使用IHC方法用于确定组织样本的IDH状态。虽然一些人主张对超过10%的肿瘤细胞进行染色以获得IDH阳性,但另一些人则认为“强”染色的肿瘤细胞就足够了。据报道,IHC染色的异质性高达46%的受试者表现出部分摄取。在2011年,Perusser等人报道IDH1-R132H表达可能仅在一部分肿瘤细胞中发生。样品的异质性也会影响基因检测的敏感性。单等位基因表达可以解释IDH异质性和某些胶质瘤报道的假阴性,其中即使存在两个等位基因,也仅表达该基因的一个等位基因。根据Horbinski的说法,测序可能并不总是足以鉴定功能上IDH1 / 2突变的肿瘤。尽管在胶质瘤的组织化学和基因组学评估中已经报告了IDH状态的异质性,但本文并未断言深度学习网络正在检测这些肿瘤中IDH突变状态的异质性。相反,IDH突变状态的形态表达可能是异质的,并反映在特定肿瘤内IDH突变和IDH野生型的混合分类输出中。无论如何,使用这种体素级别的方法的准确率都远远优于其他方法。 尽管临床上通常使用IHC方法,但多项外显子组测序研究表明,高达15%的IDH突变神经胶质瘤仍无法通过传统IDH1抗体检测发现。可以使用多种分子方法从组织中确定IDH突变状态。当前的金标准是全基因组Sanger DNA测序方法。然而,该方法受到执行遗传分析所需的时间、成本和组织体积的限制。诸如全外显子组测序之类的下一代测序方法能够以更低的成本和更小的组织体积更快地确定突变状态。但是,这些方法的假阴性率高达6%,错误率约为全基因组测序的9倍。为了进一步了解被T2-net误分类的案例,研究人员在TCGA中回顾了这些案例的数据。交叉验证集中有3个案例因IDH突变而被T2-net误分类。其中3个案例(TCGA- CS6669,TCGA-020069)证明了在活检期间获得的小组织体积,限制了分子表征。这增加了对这些肿瘤野生型的ground truth测定可能受到组织采样偏差(例如,缺乏合适的组织样品,采样位置)的可能性。 可以解释本文的网络实现更高性能的另一个因素是,以前的方法需要多模态输入,这可能由于较长的检查时间和运动造影剂的需要从而导致的患者运动而受到影响。临床脑肿瘤诊断评估期间几乎可以普遍获取高质量的T2w图像。临床上,T2w图像通常在检查开始后的2分钟内获取,并且对患者的头动较为鲁棒。在现代MRI扫描仪上,即使存在患者头动,也可以获得高质量的T2w图像。因此,仅考虑使用T2w图像的能力就具有了临床可解释性,这是一个显著的优势。该方法的灵感来自于一种类似于鉴定o6-methylguanine-dna甲基转移酶甲基化状态和预测1p/19q染色体臂缺失的方法。此外,本文的预处理步骤保存原始图像信息,不需要任何感兴趣的区域或肿瘤预分割程序。以前的基于MRI的IDH分类的深度学习算法使用了显式的肿瘤预分割步骤。这些可以通过手动描绘肿瘤或添加单独的深度学习肿瘤分割网络来完成。这些预细分步骤的使用为分类过程增加了不必要的复杂性,并且在手动预细分的情况下,使其无法作为强大的自动化临床工作流程使用。由于体素分割过程的自然结果,本文的网络能够同时进行肿瘤分割。
局限
深度学习研究通常需要大量数据才能获得良好的性能。与深度学习通常所需的样本数量相比,可从TCIA数据集中获得的数据数量相对较少。尽管如此,这些数据代表了真实世界的临床经验,来自多个机构的多参数磁共振图像,代表了最大的公开可用的脑肿瘤数据库之一。此外,在向TCIA提供数据的成像中心中,采集参数和成像供应商平台各不相同。虽然这里的结果显示了快速临床转换的希望,但是这里的算法性能将需要复制到一个独立的数据集上。
总结
本研究开发了2个用于神经胶质瘤IDH分类的深度学习网络:(i) 一个T2-net和(ii)一个高精度的多模态网络TS-net。这两个网络都超过了最先进的算法。在比较T2-net和TS-net时,也展示了相似的性能。本文的网络仅使用T2w图像,其高准确率将有助于该方法的临床转换。

微信扫码或者长按选择识别关注思影
如对思影课程感兴趣也可微信号siyingyxf或18983979082咨询。觉得有帮助,给个转发,或许身边的朋友正需要。请直接点击下文文字即可浏览思影科技其他课程及数据处理服务,欢迎报名与咨询,目前全部课程均开放报名,报名后我们会第一时间联系,并保留名额。
更新通知:第十届脑影像机器学习班(已确定)
磁共振脑影像结构班(预报名)
弥散磁共振成像数据处理提高班(预报名)
小动物磁共振脑影像数据处理班(预报名)
更新通知:第二十届脑电数据处理中级班(已确定)
脑电信号数据处理提高班(预报名)
眼动数据处理班(预报名)
近红外脑功能数据处理班(预报名)
数据处理业务介绍:
招聘及产品:
招聘:脑影像数据处理工程师(重庆&南京)