X连锁肌张力障碍-帕金森综合症(X-linked dystonia-parkinsonism,XDP)是一种神经退行性运动障碍疾病,XDP以成人肌张力障碍合并帕金森病为特征。过往影像学和病理学研究表明,XDP的肌张力障碍期的病理特征表现为纹状体中的纹状小体萎缩。纹状小体占整个纹状体体积的10 - 15%,从嘴侧到尾侧由多到少呈梯度分布,即靠近嘴侧到纹状体纹状小体比较丰富。近期定量MRI研究提示,白质和苍白球可能也与XDP的肌张力障碍有关。但仍旧对纹状体不同解剖位置的具体萎缩情况缺乏细致的认识。本研究发表在BRAIN杂志。
本篇文章旨在:(1)解析纹状体不同分区的萎缩程度;(2)研究皮层的形态变化;(3)阐明小脑在XDP中的作用。文章采集了17名以肌张力障碍为主的男性XDP患者和17名各方面配对的男性健康被试的T1加权像。分别以基底节、初级运动区为ROI做了基于体素的形态分析(VBM),同时基于全脑模板做了VBM分析,并对小脑作了单独的VBM分析。此外,文章还测量了皮层厚度和皮层下灰质体积。
结果发现,XDP的皮层下灰质体积萎缩广泛分布在纹状体各部(-29%),但萎缩最显著的区域位于纹状体联合分区(associative subdivision,-41%)。外侧和内侧苍白球也出现了不同程度的灰质体积萎缩(-19%,-12%)。皮层厚度减少主要分布在额叶(-4.3%)和颞叶(-6.1%)。
另外,在小脑的联合部位发现了灰质体素强度减小,同时发现小脑前感觉运动部分和背侧部脑桥-中脑脑干灰质体素强度增强。综上,本文对以肌张力障碍为主的XDP患者进行的皮层和皮层下灰质分析表明:
(1)富含纹状小体的嘴侧纹状体所受影响最为显著;
(2)皮层厚度仅在主要与纹状小体有结构连接的脑区变薄。此外,小脑可能同时被疾病所累并参与代偿性改变,强调了小脑在肌张力障碍的病理生理学中的重要性。
前言
X连锁肌张力障碍-帕金森综合征(X-linked dystonia parkinsonism,XDP)是一种神经退行性运动障碍疾病,是由TAF1基因的SVA逆转录转座子(将转座子从DNA-RNA-DNA的转移过程叫做逆转录转座)突变引起的一种X连锁隐性遗传病,主要影响病人为男性。XDP以成人发病、呈局灶性或节段性肌张力障碍为特征,并在几年内发展为全身性肌张力障碍。多数情况下,在5至10年后变成对左旋多巴无反应性的帕金森综合征。
在以肌张力障碍为主阶段(XDP-D),临床影响显示纹状体无萎缩或仅有轻微萎缩。但在接下来的肌张力障碍合并帕金森阶段(XDP-DP)或单纯帕金森阶段(XDP-P),尾状核头部会严重萎缩;壳核在T2加权像上显示条裂缝状的高信号,在T1加权像上显示为低信号。与此一致的是,FDG-PET显示尾状核头部和壳核代谢降低。IBZM-SPECT显示突触后纹状体多巴胺能神经传递受损。尸检结果显示,纹状体完全萎缩,但伏隔核和黑质未受影响。近期定量MRI研究证实了纹状体的萎缩,同时白质变性和苍白球萎缩会继发于纹状体的退行性变。
在人类及其他灵长目动物中,纹状体中有明显的“镶嵌”(Mosaic)结构。在该镶嵌结构中,纹状体内有神经元密度较高的区域,称为“纹状小体”(Striasome),以及将这些纹状小体隔开的“基质”(Matrix)。纹状小体约占整个纹状体体积的10-15%,其分布呈从嘴侧到尾侧的梯度分布,即纹状体嘴侧纹状小体富集,而背外侧壳核主要由基质构成。在XDP的早期阶段,纹状小体中的棘神经元退化从而导致肌张力障碍;在对左旋多巴无反应性的帕金森变的更明显时,基质中的棘神经元退化也出现了。考虑到纹状小体和基质在空间上的分布,文章推测,在XDP的早期,纹状体的嘴侧可能比背外侧表现出更严重的神经退行性变。
为了阐明这个问题,文章采集了一批以肌张力障碍为主的早期XDP患者和匹配健康对照组的高分辨率结构磁共振,并利用基于体素的分析法(VBM)和皮层厚度分析方法来评估早期XDP患者的灰质情况。
除了基底节及其对应的皮层区域,文章对小脑的灰质情况也进行了研究。以肌张力障碍为主的早期XDP中,小脑和丘脑间的连接显示出微观结构异常,这可能导致丘脑-皮层调节障碍进而导致肌张力障碍。由于XDP有明显的纹状体病理,文章推测小脑对丘脑的影响可能增加,以代偿XDP基底神经节-丘脑-皮层回路的功能障碍。考虑到VBM在分析幕下(以小脑幕为判断依据,根据小脑幕的形态来确定,小脑幕切迹在高于窦汇处呈现“v”形;与大脑镰相连处为“Y”形)结构方面的技术局限性,文章单独对小脑和脑干进行了灰质特征分析。
2 材料和方法
2.1受试者和临床量表
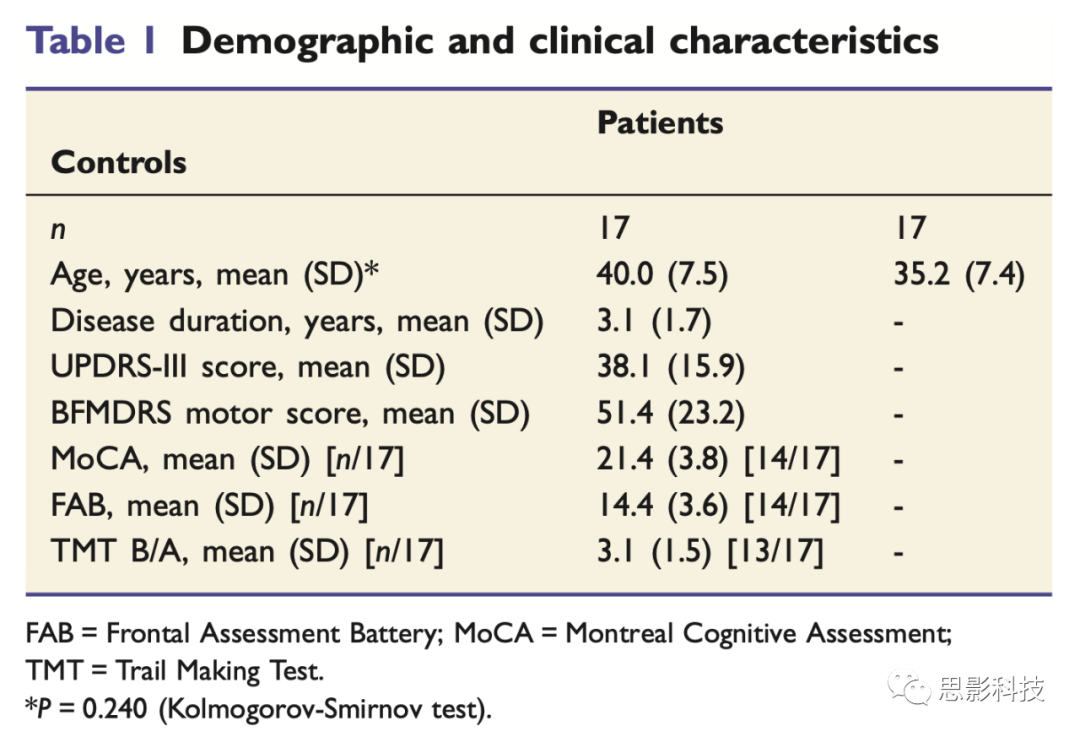
文章募集了18位通过基因确定的XDP患者(男),达到后续分析质量的数据有17位;同时募集了17位性别、种族匹配的无精神疾病的健康对照,其中7位是患者的亲属,致病基因均阴性。研究通过伦理并取得被试同意。由于年龄呈非正态分布,两组被试潜在的年龄差异通过独立样本的非参数Kolmogorov-Smirnov检验确定。
临床量表:用运动功能障碍评定量表(BFMDRS)评估患者的运动功能,用统一帕金森病评定量表第三部分(UPDRS-III)评估患者帕金森状态。用MoCA、FAB、TMT评估患者的认知功能,用TMT-B与TMT-A的比值衡量执行功能。
2.2 MRI数据采集
13位患者和健康对照组的T1像用Philips Achieva 3.0T磁共振的快速梯度回波3D MPRAGE序列采集,参数为:矢状位,无间隔180层,矩阵240*240,体素1*1*1mm3,FOV为240mm*240mm*180mm,翻转角9o,TR为6.6ms,TE为3.0ms。
4位患者的T1像用Philips Ingenia 3.0T磁共振的快速梯度回波3D MPRAGE序列采集,参数为:矢状位,无间隔180层,矩阵240*240,体素1*1*1mm3,FOV为240mm*240mm*180mm,翻转角9o,TR为6.8ms,TE为3.1ms。VBM分析时会将两台机器作为协变量考虑进去。
此外,文章还采集了17位XDP患者和16位健康对照的DTI数据,参数为:32个梯度方向,70层,体素2*2*2mm3,1个b0像,高b值为1000s/mm2,TR为7582ms,TE为60ms。
2.3基于体素的形态分析(灰质体素强度)
2.3.1预处理
预处理采用SPM8和DARTEL完成。(思影可以手把手教零基础的你,包能懂会用,完全没必要像文章里写的这么不清楚还麻烦)。
首先,在MNI坐标系中手动头动校正。其次,根据SPM8的先验模板将校正后的图像分割成灰质、白质、脑脊液;因为研究对象为东南亚血统,因此选择ICBM的东亚模板,并进一步用DARTEL的方法进行空间标准化,将每个被试的图像标准化到MNI空间。然后,图像调制,保留每个图像的灰质体素强度信息。最后用FWHM为8mm的平滑核进行平滑。
为了进行统计分析,文章建立了一个包含两个协变量(年龄和扫描机器)的广义线性模型(GLM)。用灰质体积除以颅内总容量(灰质+白质+脑脊液)实现全局的归一化。使用独立样本t检验分别比较健康对照组大于患者组的脑区和健康对照组小于患者组的脑区。结果采用voxel的FWE校正,显著阈值p<0.05,且团块大于10个体素。
2.3.2基于感兴趣区的分析
用WFU模板提取感兴趣区,包括:壳核、尾状核(尾状核头、尾状核体、尾状核尾)、苍白球(内侧苍白球、外侧苍白球)、黑质和初级运动区(M1,BA4),并将感兴趣区转化至MNI空间(因为WFU模板建立在Tailarach空间)。这些感兴趣区的选择是基于文献和作者前期的研究结果,具体如下:尸检和磁共振成像均发现XDP患者的纹状体存在严重的神经元丢失,包括全部的壳核和尾状核。前期还有研究提示一小部分XDP患者的苍白球灰质体积发生变化。选择黑质是因为XDP患者通常会发展为帕金森,而且纹状小体的中型棘神经元直接投射至黑质的多巴胺神经元。选择M1是因为它支配运动。
2.3.3全脑分析和基于纹状体分割的纹状体灰质结构分析
对于全脑分析,选择SPM8里的全脑模板并卡0.2的阈值。结果采用FWE校正,显著阈值p<0.05,且团块大于10个体素。用FSL中的Fslstats提取感兴趣区显著团块的平均体素强度,并用SPSS21.0进一步分析组间差异。为进一步分析纹状体萎缩可能存在的梯度分布,利用FSL提供的基于白质纤维连接的纹状体分割模板(根据对应的皮层脑区,纹状体被分为边缘区、联合区和感觉运动区),研究纹状体各分区的灰质强度情况。
2.3.4小脑和脑干分析
小脑和脑干的VBM分析是利用SUIT工具包实现的。SUIT工具包提供小脑和脑干的高分辨率图谱,非常适用于幕下结构的结构分析。预处理包括手动重定位至前联合;分离、分割小脑,必要时手动校正小脑mask;DARTEL标准化至SUIT MNI模板;最后用4mm的平滑核平滑。
同样使用独立样本t检验分别比较健康对照组大于患者组的脑区和健康对照组小于患者组的脑区,绝对阈值0.1。结果采用FWE校正,校正显著性阈值p<0.05。显著差异的小脑区域利用SUIT工具包提供的小脑模板进行定位和显示。
2.4基于表面的形态分析(皮层下灰质体积和皮层厚度测量)
皮层下灰质体积和皮层厚度的测量利用Freesurfer实现。预处理根据Freesurfer的标准流程包括:去除非脑组织,皮层下灰质、白质分割,强度归一化,灰质-白质边界网格化,自动拓扑校正,曲面变形等。预处理过程中,手动检查剥颅骨效果、分割效果等,如有错误,修正错误后重新计算直至检查无错误。最后用10mm的平滑核平滑,并标准化到freesurfer自带的fs-average空间。
以年龄为干扰因素,分组(健康对照/病人)为独立因素构建广义线性模型。组间比较结果的多重比较校正采用Monte Carlo模拟校正,校正阈值为p<0.05;两侧半球间的比较采用Bonferroni校正。基底节区灰质体积的比较利用将Freesurfer得到的灰质体积信息导入到SPSS实现。
2.5弥散加权成像
文章针对“由VBM分析得到的具有显著组间差异的脑干区域是否与小脑跟对侧丘脑间的解剖连接相关?”问题做了白质纤维追踪。因为以往研究报道不同形式的肌张力障碍会伴有小脑-丘脑束的微观结构变化。该部分内容是一个探索性研究。 该部分数据处理基于FSL5.0中FMRIB的Diffusion工具包实现的。分析步骤包括:脑提取(其实就是剥头皮)、涡流/头动校正、张量拟合、概率性纤维追踪。纤维束起始区域定义在具显著组间差异的脑干区域(峰值点周围6mm的球形范围);终点区域定义在小脑V区(基于概率小脑MR图谱,Diedrichsen et al,2009)及双侧丘脑(基于Harvard皮层下脑图谱,Desikan et al,2006),假设这些区域适合用于评价小脑丘脑束。概率追踪的连接概率阈值设定为25%,追踪出来的纤维束通过人工检测校正。利用平均FA、MD和追踪出的纤维束条数来量化白质纤维追踪结果。采用独立样本t检验进行组间比较,多重比较校正采用Bonferroni校正(因为被统计量为3个,即FA、MD和纤维束条数,故P<0.05/3)。
2.6统计分析
统计分析利用SPSS实现,主要进行了校正年龄的ANCOVA,混合模型ANCOVA和校正年龄和颅内总体积(如需)的偏相关分析。所有的结果中均报告了校正的F值和P值和未校正的自由度。在偏相关分析中用Grubbs检测定义异常值并剔除。定义显著性阈值为P<0.05(双边)。基底节区的共进行了基于感兴趣区的VBM,基于全脑的VBM和皮层下体积三种分析,所以采用Bonferroni校正后,显著性阈值为P<0.05/3。
3.结果
3.1人口统计学特征和临床评估
文章共分析了17位男性XDP患者和17位男性年龄匹配(P=0.240)的健康对照的数据[均值(标准差),患者组:40.1(SD:7.5),对照组:35.2(SD:7.4)]。所有的病人都进行了TAF1基因中致病的SVASVA逆转录转座子检测。
患者组截至MRI采集时的患病时间都比较短(3.1年(SD:1.7),范围在1~7年)。13位患者处于XDP的运动障碍期(XDP-D),4位患者处于XDP的运动障碍、帕金森混合期(XDP-DP)。BFMDRS运动评分均值为51.4(SD:23.2)(总分数为120分),最高值为88,说明所纳入患者的运动障碍都比较严重。UPDRS-III评分均值为38.1(SD:15.9,UPDRS-III总分为108分)。
患者组中有13例在MRI扫描时接受了抗肌张力障碍的药物治疗,但仅有有限的反应。具体为:氯硝西泮( 10例)、双哌啶酮( 8例)、唑吡坦( 5例)、左旋多巴( 3例)、地西泮( 1例)。将药物因素作为不感兴趣的回归因子时,结果无变化。
3.2基于体素的形态分析
3.2.1基底节
基于感兴趣区的分析结果显示患者组的壳核、尾状核和苍白球的灰质体素强度显著下降,但黑质和初级运动区的体素强度无显著组间差异(图1A,表2)。表2 基于感兴趣区的VBM分析(患者组<对照组)
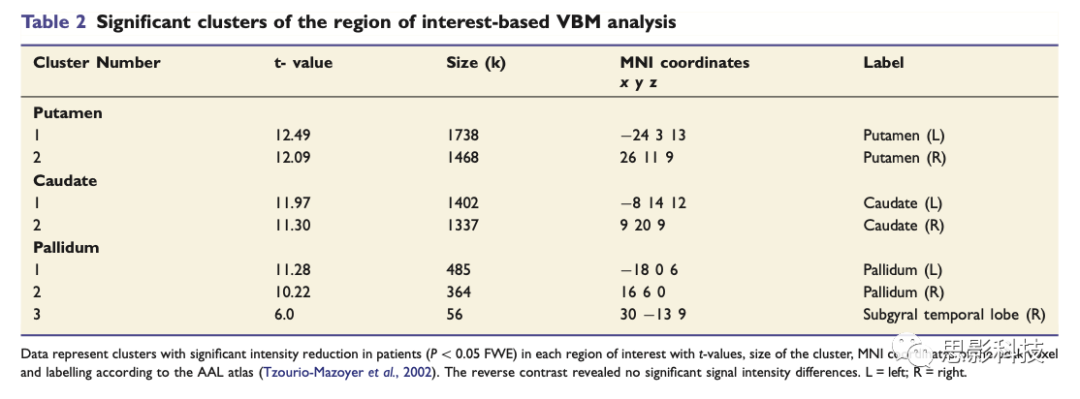
注:具有显著组间差异的脑区(P<0.05,FWE),采用AAL模板标注。对于患者组>对照组的统计无显著差异脑区。
全脑分析结果同样发现了壳核、尾状核和苍白球的灰质体素强度显著下降,其他脑区无显著改变(图1B,表3)。对于患者组>对照组的统计在开始定义的FWE校正后也无显著差异,但用一个较低的显著水平调整团块水平后(即,FWEc<0.05,团块阈值改为P<0.001),两个团块(小脑和背侧部脑桥-中脑脑干)显示出显著组间差异(图1C,表3)。表3 全脑VBM分析
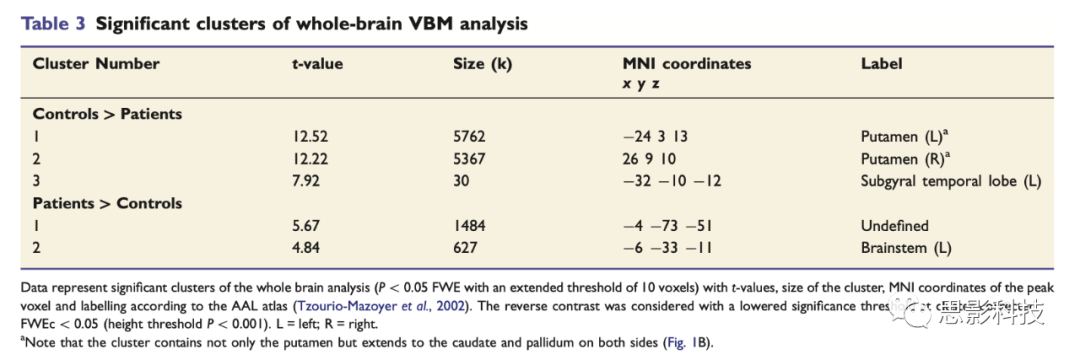
注:对于对照组>患者组的统计具有显著组间差异的脑区(P<0.05,FWE校正,团块体素个数阈值为10)。对于患者组>对照组的统计均有显著差异的脑区(FWEc<0.05,显著水平小于前者,团块体素强度阈值P<0.001). 注意:图1B中显示显著差异的脑区不仅有双侧壳核还有双侧尾状核和苍白球。
通过对所提取的感兴趣区的平均灰质体素强度的协方差分析再次证实壳核[F(1,31) = 85.40]、尾状核头[F(1,30) = 47.50]、尾状核体[F(1,31) = 73.55]、外侧苍白球[F(1,31) = 50.95]、内侧苍白球[F(1,31) = 21.87](P<0.001)的发现。准确的说,与对照组相比,XDP患者的平均灰质强度在壳核下降29%,尾状核头下降24%,尾状核体下降41%,外侧苍白球下降19%,内侧苍白球下降12%(图2A-C)。
尾状核尾[F(1,31) = 2.43, P = 0.129]、黑质[F(1,31) = 0.72, not significant (ns)]和初级运动区[F(1,30) = 0.30, ns]的灰质强度组间差异不显著。同时,结果显示外侧苍白球比内侧苍白球有更大程度的萎缩[F(1,31) = 70.43, P<0.001]。此外,尾状核头(r = −0.742, P = 0.002)、尾状核体(r = −0.630, P = 0.009)、以及外侧苍球(r = −0.563, P = 0.023)的灰质体素强度与疾病病程呈显著负相关,而内侧苍白球(r = −0.471, P = 0.066)和整个壳核(r = −0.515, P = 0.050)的灰质体素强度与疾病病程无显著相关(见原文附件)。
接着,作者对基于连接的纹状体分区的灰质体素强度进行组间比较。XDP患者所有纹状体分区的平均灰质体素强度均显著下降,下降最显著的为纹状体的联合分区[边缘分区: F(1,31) = 55.00; −26%, 联合分区: F(1,31) = 97.11: −41%, 感觉运动分区: F(1,31) = 78.36; −27%, P < 0.001](图2D)。因此,组间的交互作用×纹状体分区是非常显著的[F(2,60) = 78.46, P < 0.001]。疾病病程与纹状体的边缘分区 (r = −0.632, P = 0.009)、联合分区(r = −0.567, P = 0.028) 的平均灰质体素强度分别呈显著负相关,但与感觉运动分区相关性不显著(见原文附件)。且XDP患者纹状体联合分区的结构改变与认知评分(如MoCA,FAB,TMT)均不相关。
 SHAPE \* MERGEFORMAT
SHAPE \* MERGEFORMAT
图1 基于体素的形态分析。
显著差异(P<0.05,FEW校正)的体素用彩色表示,色彩强度代表体素的t值。显著差异的体素所覆盖的底板为MNI152 T1模板。峰值对应的坐标分别见表3(图A)和表4(图B和C)。
(A)ROI比较,对照组>患者组;
(B)全脑比较,对照组>患者组;
(C)全脑比较,患者组 >对照组;
(D)小脑和脑干分析。
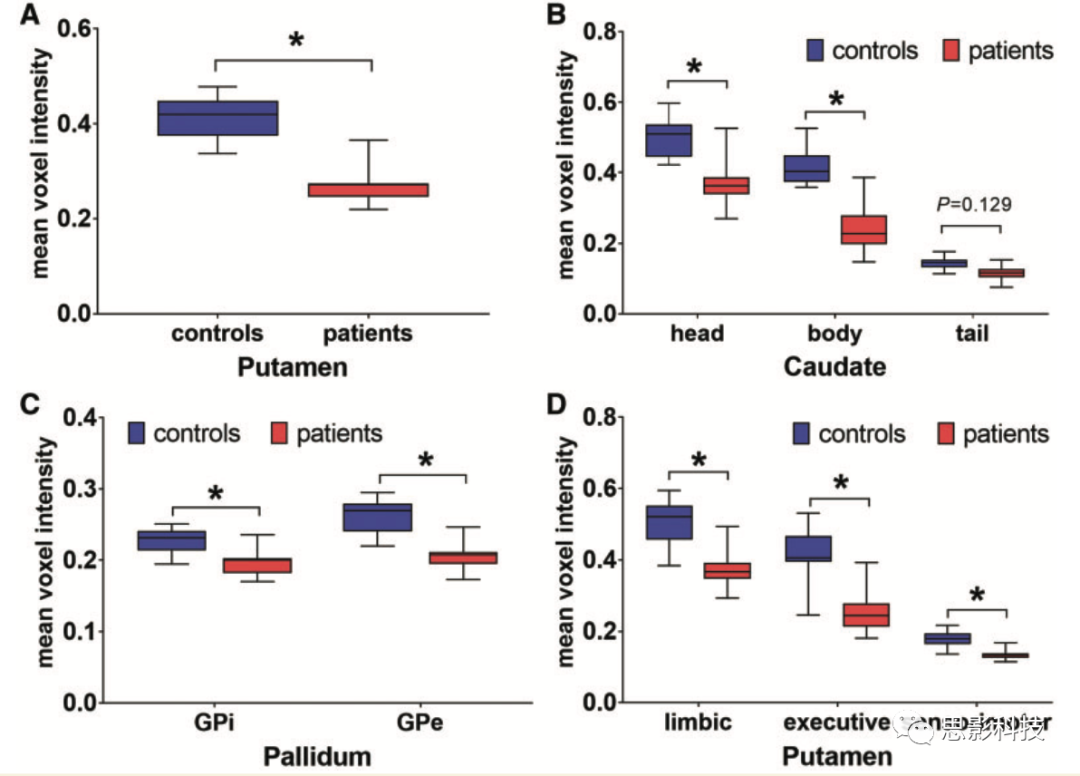
图2 VBM的量化分析。
(A-C)平均灰质体素强度的组间对比,(A)壳核,(B)尾状核,(C)苍白球。(D)基于连接的纹状体分区平均灰质体素强度的组间比较。
3.2小脑和脑干
小脑的VBM分析显示,XDP患者在小脑蚓部I,小脑蚓部II外侧,双侧小脑叶VIIb的灰质体素强度显著下降;而在双侧小脑叶I-IV,左侧小脑叶V,和背侧部脑桥-中脑脑干灰质体素强度显著增加(图1D)。认知评分与对应的小脑灰质改变无相关性。
3.3体积
与VBM分析结果一致,壳核[F(1,30) = 153.00]、尾状核[F(1,30) = 78.58]和苍白球[F(1,30) = 61.98]的体积存在显著的组间差异(P<0.001)。具体来说,患者组壳核的平均灰质体积减少43%,尾状核减少44%,苍白球减少41%(图3A-C)。减少的尾状核体积与疾病病程呈显著负相关(r =−0.567, P = 0.034) (图3D),但疾病病程与壳核和苍白球的相关性不显著。
除了基底节区的灰质体积萎缩,患者组的整个皮层下灰质总体积也显著缩小(减少21%,F(1,30) = 104.36, P < 0.001);整个皮层体积也有轻微缩小(减小7%,F(1,30) = 9.63, P = 0.004)。显著缩小的皮层下灰质总体积与UPDRS运动部分的评分成显著相关。

图3 基底节区体积的定量分析。
(A-C)分别为壳核、尾状核和苍白球的灰质体积。(D)显示尾状核体积与疾病病程呈显著负相关。
3.4皮层厚度分析
组间灰质皮层厚度无显著差异(蒙特卡洛模拟校正,P<0.05),但患者组的整体皮层厚度存在轻微变薄(减少4.4%, F(1,31) = 7.55, P = 0.01)。各脑叶平均皮层厚度的协方差分析显示额叶(减少4.3%,F(1,31) = 6.28, P = 0.018)和颞叶(减少6.1%,F(1,31) = 13.14, P = 0.001)的皮层厚度轻微变薄,脑岛[F(1,31) = 1.47, P = 0.235]、扣带回[F(1,31) = 2.94, P = 0.097]、枕叶[F(1,31) = 3.10, P = 0.088]和顶叶[F(1,31) = 3.46, P = 0.73]均无显著改变。
3.5概率追踪
该部分为简单的探索性研究。正如上面提到的,VBM分析提示XDP患者组背侧脑桥-中脑脑干灰质体素强度升高。由于先前研究报道,这一区域与不同形式肌张力障碍的小脑-丘脑束的微观结构变化有关,我们将该区域设为种子点(起始点),分别与小脑(小脑脑叶V)和丘脑做概率性纤维追踪,由此我们可以重建连接小脑和丘脑并途径该区域的纤维束,患者组有9人(共17人),对照组有8人(共16人有DTI数据)重建出纤维束,如图4。

图4 示例病人(L-7992)追踪出的纤维束。红黄色的显示为丘脑和小脑脑叶V,蓝色显示为小脑-丘脑束。定量分析显示,对于重建的纤维束,患者组(0.343 ± 0.016)的FA值小于对照组(0.394 ± 0.016),但组间差异多重比较校正后不显著[P = 0.041 (>0.0167)]。文章对组间的MD和纤维束条数也进行了比较。MD:(XDP患者组 0.73 ± 0.011 v.s. 对照组 0.71 ± 0.012, P = 0.255),纤维条数: (XDP患者组26240 ± 3812 v.s. 对照组 27831 ± 4080, P = 0.577)。
4.总结
通过定量MRI分析,文章发现在XDP早期即以运动障碍为主的时期,XDP患者纹状体的联合分区明显萎缩。灰质体积的萎缩除纹状体外还涉及到外侧和内侧苍白球,尽管程度要比纹状体小。小脑-丘脑通路的增强(表现为背侧脑桥-中脑脑干灰质体素密度的增强,而该部位为小脑-丘脑连接通路的一部分)可能是大脑对抗解除抑制的皮层-大脑皮层-皮层环的一种机制。
相反的,小脑的后部出现灰质的丢失(尽管没有纹状体丢失的严重),这对目前认为XDP是单纯纹状体病变的疾病模型提出了新的挑战。综合本文的所有分析来看,在假设检验分析部分,使用了比较简单但是严格执行统计分析原则的假设检验,VBM和皮层后度分析从方法上看已经是很成熟的研究手段,并且实现难度也不大,但是需要规范的研究过程。而对于探索性分析,发现新问题比验证假设更加重要。综合来看,本文找到了一个很好的疾病切入点来实现神经影像分析手段和研究问题恰到好处的融合。

微信扫码或者长按选择识别关注思影
如对思影课程感兴趣也可微信号siyingyxf或18983979082咨询。觉得有帮助,给个转发,或许身边的朋友正需要。请直接点击下文文字即可浏览思影科技其他课程及数据处理服务,欢迎报名与咨询,目前全部课程均开放报名,报名后我们会第一时间联系,并保留名额。
更新通知:第十届脑影像机器学习班(已确定)
磁共振脑影像结构班(预报名)
弥散磁共振成像数据处理提高班(预报名)
小动物磁共振脑影像数据处理班(预报名)
更新通知:第二十届脑电数据处理中级班(已确定)
脑电信号数据处理提高班(预报名)
眼动数据处理班(预报名)
近红外脑功能数据处理班(预报名)
数据处理业务介绍:
招聘及产品:
招聘:脑影像数据处理工程师(重庆&南京)