局灶性脑损伤是深入了解潜在神经、精神症状的神经解剖学基础。几十年前就已有对中风和脑肿瘤的左额叶损伤和抑郁有关的相关研究报道。随后的研究进一步阐明了这种关联与背外侧前额叶皮层(DLPFC)病变的关系。这些病灶的定位研究非常重要,因为抑郁症是脑卒中发病率和死亡率的独立预测因子。其次,这些病变的定位研究对于深入了解原发性抑郁症的神经解剖学也很重要,包括治疗靶点的确定。
例如,首次对左侧背外侧前额叶皮层进行经颅磁刺激(TMS)治疗原发性抑郁症的试验中,部分是由病变数据驱动的。然而,基于局灶性脑损伤的抑郁定位一直存在不同看法。早期的研究也指出,大多数卒中后抑郁患者的病变位于左额叶皮层之外。旨在复制这种联系的研究发现,这种联系只在特定的时间点才成立,或者根本不成立。多项Meta分析也未能发现左侧额叶病变与抑郁症之间的联系。
使用基于体素病灶-症状图(voxel-based lesion-symptom mapping)等新方法的研究也未能发现与抑郁症显著相关的病变部位。这些发现不一致的一个潜在原因是:引起类似症状的病变可能定位于脑网络,而不是单个的大脑区域。同样,由局灶性损伤引起的症状可能来自与病灶位置相关的脑区,而不是病灶位置本身,这种现象称为神经机能联系不能(diaschisis)。一种最近被证实的技术——病灶网络映射可以更好地解释这些因素,并将其纳入基于损伤的定位中。该方法利用大量健康受试者的连接组数据,将病变位置作为静息状态功能连接分析的种子区域,通过比较与特定症状相关的病变的功能连接特征,可以识别出感兴趣症状下的特定的大脑网络区域。这项技术已被证明对理解幻觉、妄想、犯罪、甚至是自由意志的紊乱是有用的。
来自贝斯以色列女执事医疗中心的研究人员对这局灶性损伤和抑郁之间的关系使用基于人脑连接体的病灶映射网络方法进行了研究。在本研究中,他们通过5个独立的损伤数据集和几种损伤原因(缺血性中风、脑出血和穿透性脑损伤)分析了损伤位置与抑郁的关系。相关成果发表在Biological Psychiatry杂志上。
摘要:
目的:大脑的局灶病变是深入了解导致抑郁症的神经解剖学基础。然而,针对不同病变部位的研究结果并不一致。通过相关大数据集分析损伤位置与抑郁的关系对于理解研究结果间的异质性问题有重要意义。
方法:
对5个独立的、不同病变原因和病变后不同抑郁程度的数据集进行比较(N = 461),病变位置通过三维映射到一个共同的脑图谱。
(1)使用基于体素的病变-症状图谱(voxel lesion symptom mapping)来检测抑郁的产生与病变部位之间的关系。
(2)使用标准连接体数据集(N= 1000)来计算与病灶功能连接的区域网络,然后使用这些损伤网络图来检测抑郁和大脑回路间的联系,并采用“留一法”验证评估的可重复性。
(3)测试与抑郁症相关的病变位置是否与能有效改善中风后抑郁的脑刺激部位位于同一回路内。
结果:与抑郁相关的病变部位高度不均,且不涉及单一的大脑区域。然而,当相同病变位置映射到大脑回路时,区域集中在左侧背外侧前额叶皮层(DLFPC),“留一交叉验证”显示结果稳健可靠。并且,选择的经颅磁刺激靶点位置与病变对应的抑郁回路一致时可有效改善中风后抑郁。
结论:与抑郁症相关的病变位置无法映射到特定的大脑区域,但可以映射到特定的脑回路。该回路可用于判断卒中后抑郁患者的预后,也可用于确定经颅磁刺激的靶点位置。
补充材料:
第一个数据集包括脑出血患者,使用the Neuro Quality of Life scale 和 NIH Patient Reported Outcomes Measurement InformationSystem (PROMIS)量表的计算机自适应测试版本评估抑郁症,收集不同受试者在不同时间点(出院后28天、3个月或12个月)的得分。得分以均数为50、标准差为+/- 10的T分表示。作者使用了一个在线工具,它提供了患者健康问卷-9 (PHQ-9)、标准抑郁量表和神经生活质量/PROMIS抑郁亚量表原始分数之间的转换。结果发现,在PHQ-9上,标准阈值为4和10(无抑郁和中度抑郁)分别相当于50.5和59.9的神经生活质量/PROMIS 的T评分。因此,作者使用这些临界值将10名受试者划分为抑郁(均值= 65.0,标准差= 4.7),23名受试者划分为非抑郁(均值= 42.6,标准差=5.9),在初步分析中排除了18名受试者。在此数据集中无法获得关于损伤前抑郁史或抗抑郁药物治疗的信息。
第二个数据集包括有首发神经损伤症状的卒中(缺血性或出血性)受试者,在卒中后3个月和1年使用GDSS量表评估抑郁症。但本研究仅使用了3个月的评估。在初步分析中,作者将GDSS≤5的受试者分为“非抑郁”, GDSS≥11的受试者分为“中度至重度抑郁”。这些临界值是基于GDSS原始作者设置的参数,其中GDSS≥11被归类为“确定抑郁”,而那些评分为> 5和< 11的被归类为“提示抑郁”。
结果14名受试者有中度至重度抑郁(平均GDSS12.0,标准偏差1.0),73名无抑郁(平均GDSS 2.2,标准偏差1.7),排除了13名有轻度或可疑抑郁。数据集包含了抑郁病前病史的信息,但不包含抗抑郁药物的信息。
第三个数据集由缺血性卒中患者组成,在卒中后3个月用PHQ-9进行评估。在初步分析中,作者将PHQ-9评分≤4的受试者划分为“不抑郁”, PHQ-9评分为≥10分的受试者划分为“抑郁”,参数是由PHQ-9的作者设定的。结果:5名受试者有中度至重度抑郁(平均PHQ-9 为13.0,标准偏差3.3),44名受试者无抑郁(平均PHQ-9 为 2.1,标准偏差1.4),排除14名受试者有轻度或可疑抑郁。该研究排除了中风前有精神病史(包括抑郁史)的受试者。
第四个数据集包括首发缺血性或出血性脑卒中的受试者,在卒中后一个月使用HADS量表评估抑郁。得分≥11的患者进行半结构化的临床访谈(MINI),以确定是否存在符合DSM-IV标准的重度抑郁症(卒中后出现重度抑郁症特征)或轻度抑郁症(卒中后出现抑郁特征)。在初步分析中,作者根据之前公布的数据集分类将受试者分为“非抑郁症”和“重度抑郁症”。结果有7名研究对象患有重度抑郁症,38名对照组,排除被原作者归类为“轻度抑郁症的”6名被试。该数据集包含了抑郁症病变前病史的信息。在作者的分析中三个受试者在评估时均接受了抗抑郁药的治疗:一个受试者是对照组,另外两个在原始数据集中被归类为“轻度抑郁”(相当于他们分析中的“轻度或可疑抑郁”)。
第五个数据集由具有穿透性颅脑损伤的越战老兵组成,他们在受伤后约33-39年用the Beck DepressionInventory II进行了评估。作者将BDI-II得分≤8将受试者分类为“非抑郁”,而BDI-II得分≥20将受试者分类为“中度至重度抑郁”。这些临界值与该数据集的先前分析中使用的值相同。结果有22名抑郁受试者(平均BDI得分29.9,标准偏差5.6)和122名非抑郁受试者(平均BDI得分3.6,标准偏差2.4),排除52名在原始分析中轻度或可疑抑郁症(BDI范围9-19)的受试者。该数据集没有病前抑郁或抗抑郁药物史的信息。
总的来说,作者使用二分类变量表示抑郁状态(抑郁与非抑郁),对数据集中358个病灶进行初级分析。在将抑郁作为连续变量的分析中,纳入了之前排除的103名轻度或可疑抑郁的受试者(N = 461)。并且对每个数据集内的抑郁评分(Neuro QOL, GDSS, PHQ-9,HADS, BDI-II)进行Z变换,以便跨数据集分析。
方法与材料:
受试者和病变:
本研究得到贝斯以色列女执事医疗中心机构审查委员会的批准(研究方案编号:2018P000128)。作者先进行系统的文献检索,以确定包含抑郁评估的病变数据集,并写信给调查人员寻求完整数据(补充方法)。纳入5组独立的病变数据,共461例,病变原因、抑郁程度、抑郁评估时间各不相同(Table 1,Figure 1,Supplementary Methods)。分析主要集中在中度至重度抑郁症患者(N = 58)与无抑郁症患者(N = 300,“对照组”或“非抑郁对照组”)间,使用各抑郁量表(Supplementary Methods, Table 1)确定的界限。并用“抑郁”和“非抑郁”的二元对比作为主要分析,原因有三:
(1)与相关卒中后抑郁的文献保持一致,包括作者试图复制研究结果的研究。
(2)可将具有不同抑郁程度的数据集结合起来,抑郁程度为二元分类的界限。
(3)因为抑郁量表受到许多因素的影响,所以关注极端更容易识别其与病变位置的关联。
此外,作者也将抑郁程度作为一个连续变量,重复了他们对整个队列病变(N = 461)的分析。为了跨数据集执行分析,每个数据集内的受试者的抑郁评分与同一数据集内的其他受试者行z评分变换,生成每个受试者的标准化连续抑郁评分。基于CT或结构MRI图像对病变区域进行人工分割,归一化为MNI152图谱空间,再二值化,使病变内的体素值为1,其余所有体素值为0。将病变模板一起添加以创建病变叠图(Supplementary Figure S1)。
Table1. Subject Demographics.
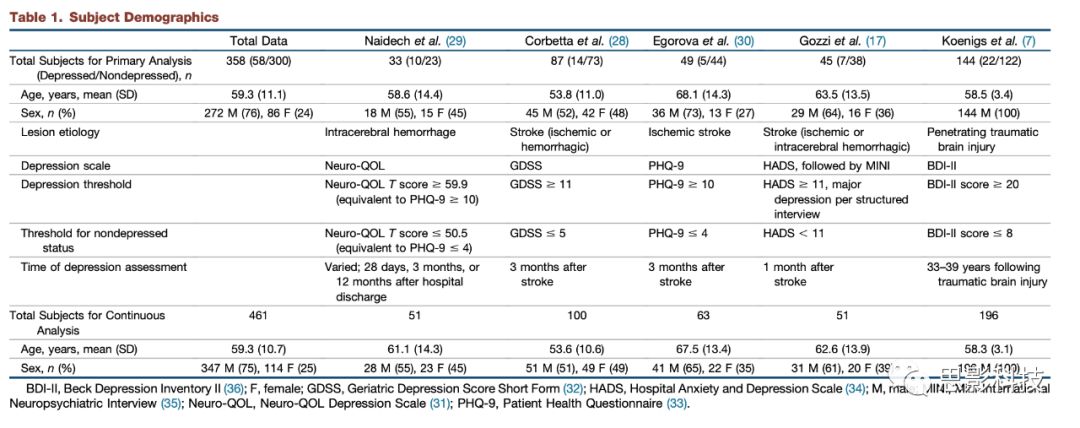
Figure1:从收集到的五个数据集看,来自抑郁和非抑郁受试者的病变在病变位置上显示出异质性
Supplementary
Table S1. 使用NiiStat工具制作基于体素的损伤-症状映射
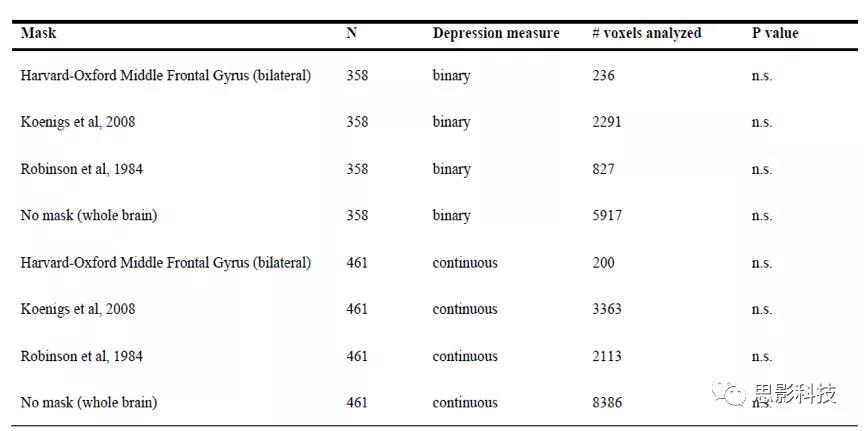
在两个数据集(N = 358)中进行了病变位置分析,该数据集排除了轻度或可疑抑郁症患者并使用二分类变量表示抑郁或非抑郁状态,而连续数据集则包括所有受试者并使用表示抑郁症严重程度的连续变量。

Supplementary Figure S1. 病变叠加图:阈值为0
A. 抑郁患者病灶重叠图(N=58), max = 8.
B. 对照组病变重叠图(N=300), max = 26.
C. 抑郁与对照病变重叠图(轻度或可疑抑郁除外,N = 358), max = 32.
D. 所有病变位置的叠加图(N=461), max = 40.
图示的MNI坐标的Z值: Z= -25,-5, 15, 35, 5
局灶性损伤分析:
为了识别任何与抑郁症相关的受损脑体素,作者使用Matlab软件里的 NiiStat进行基于体素的病灶症状映射(voxel-based lesion symptom mapping,VLSM),病灶大小和数据集作为协变量,使用标准设置和统计截断值(Supplementary Methods)。
为了最大限度地提高敏感度,将分析重点放在背侧前额叶皮层(DLPFC),其定义使用了哈佛大学牛津地图集“额中回”(MFG)区域和>0%概率的截止点(尽可能包括MFG区域)。文献提示DLPFC与抑郁症有关,因此将其作为经颅磁刺激的治疗靶点。为了确保结果不依赖于对ROI的选择,作者使用另外两种DLPFC ROI进行了重复分析,这两种ROI被用于之前的病灶位置和抑郁症的研究(Supplementary Figure S2)(现在的常用方法,来排除由于ROI选择带来的研究偏见)。为了确保没有遗漏DLPFC之外的重要结果,作者还使用了无模板数据(no mask,即包括整个大脑)。最后,将抑郁作为一个连续变量而不是一个二分类变量进行重复分析,包括了所有病变位置(N = 461)。
除了上述的体素分析外,作者还从之前的研究中复制了基于ROI的分析,这些研究证明了病变位置与抑郁症之间的正相关关系,并测试了抑郁症与左右半球病变之间的相关性(Supplementary Methods, Supplementary Figure S2)。总的来说,作者一共测试了与这些ROI相关的病变交叉的七个先验假说。
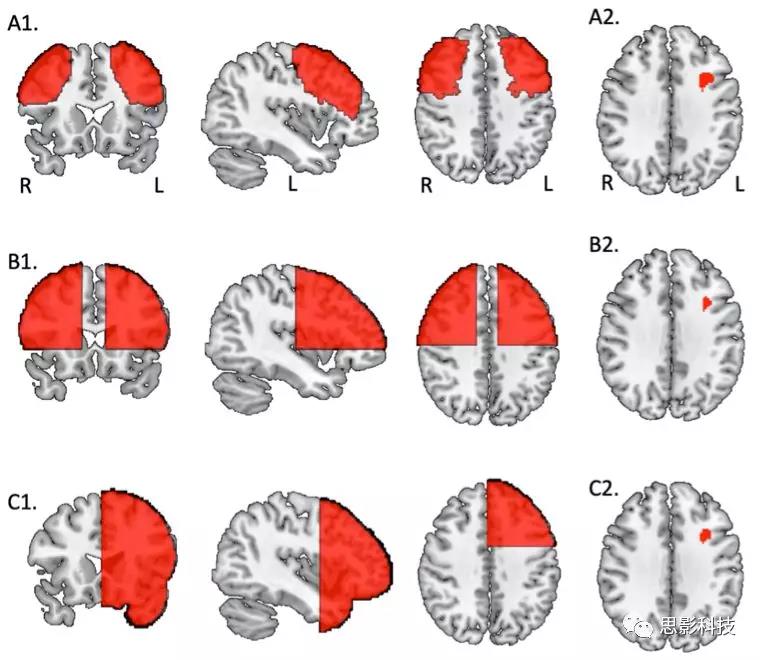
Supplementary Figure S2.
A1. Harvard Oxford bilateral middle frontal gyrus (x=40,y=20, z=40).哈佛-牛津双侧额中回(x=40, y=20, z=40)。
A2. 一般线性模型的结果:比较抑郁和对照受试者的病灶网络图,再用哈佛牛津大学图谱中的额中回进行掩模(体素概率为>0%),并行体素水平FWE校正。红色体素通过多次比较校正(peak: T = 4.37, pc = 0.0050, coordinates x = -32, y = 12, z = 36)
B1. Koenigs ROI (x=40, y=20, z=40)(来自Koenigs et al, 2008)
B2.一般线性模型的结果:比较抑郁和对照受试者的病变网络图,掩模至Koenigs DLPFC,并进行体素水平的FWE校正。红色体素通过多重比较校正(peak: T = 4.37,pc = 0.013,coordinates x = -32, y = 12, z = 36)
C1. Robinson. ROI (x=40, y=20, z=40)(来自Robinson et al,1984)
C2.一般线性模型的结果:比较抑郁症和对照组d的病变网络图,掩模到Robinson ROI,进行体素水平的FWE校正。红色体素通过多次比较校正(peak: T = 4.37,pc = 0.0096; x = -32, y = 12, z = 36)
病变网络映射
使用之前验证过的病变网络映射方法,作者测试了与抑郁相关的病变区域是否能映射到大脑连接回路。利用1000名健康受试者的静息状态功能连接数据计算每个病变位置与其他体素之间的功能连接(Figure2, Supplementary Methods)。

Figure2 与抑郁症相关的病变位置与大脑回路相交(即在大脑回路中),而不是单独的脑区
(A)抑郁受试者和非抑郁受试者的病变样本用绿色表示。标准的基于体素的损伤-症状图没有发现与抑郁症显著相关的损伤体素。
(B)利用1000名健康对照者的静息状态功能连接数据,计算每个病变位置与大脑其余部分的功能连接。左侧背外侧前额叶皮层的一个局灶区显示,与非抑郁症患者的病变相比,该局灶区与抑郁症患者的病变具有更强的功能连接(红色表示; FEW校正 p <0.05)。
(C)使用标准连接体数据,作者检查了该区域的全脑功能连接,产生了一个抑郁回路。根据定义,来自抑郁受试者的病变将与这个网络的阳性节点相交(样本病变用紫色表示),而来自非抑郁受试者的病变不会相交(样本病变用青色表示)。在面板B和C中,红-黄表示与该区域正相关,蓝-绿表示与该区域负相关。为了便于可视化,网络映射在T=±5处进行阈值化(实际的网络映射未进行阈值化)。C组的Z坐标:-25,-5,15,35,55。
使用一般线性模型(并使用置换检验进行统计分析,FSL)对抑郁(N = 58)和非抑郁对照组(N = 300)中没有阈值的病变网络图进行统计比较,协变量为数据集和病变大小,每个病灶的位置不排除在相应的病灶网络图中。
在VLSM(基于体素病灶-症状图)分析中,作者在the Harvard Oxford bilateral MFG模板中寻找重要的结果。对多重比较后的模板内的所有体素进行保守的FWE校正(p <0.05)。这比使用的基于团块的校正(cluster-based correction)更严格,后者检测阈值与假阳性相关。同VLSM分析,作者使用另外两个DLPFC模板进行重复分析。
从分析结果中提取出差异体素作为感兴趣的种子区域,并使用1000名健康受试者的标准连接体计算该区域与大脑其余部分的功能连接。根据定义,这个称之为“抑郁回路”的网络图包含了与抑郁相关的病灶,同时避开与抑郁无关的病灶。作者再使用具有常见病变病因(缺血性卒中、出血性卒中、穿透性颅脑损伤)的病变亚组和无损伤前抑郁史的病变亚组重复了这一分析。通过空间相关性评估与抑郁回路(N = 358)的相似性(Supplementary Methods)。
留一交叉验证以及脑网络损伤评分
为了确保研究结果不受五个数据集中的任何一个数据集的影响,并且测试抑郁症回路是否能够预测独立数据集的抑郁症,作者进行留一交叉验证。他们统计比较了5次抑郁症患者和对照组患者的病变网络图,每次都排除5个数据集中的一个。通过体素水平的FWE校正的体素被提取为感兴趣区域(Figure 3A)。
然后,依次将这五个感兴趣的区域作为种子区域,并使用标准连接体数据集(N =1000)计算它们与大脑其余部分的功能连接,得到五种不同的“抑郁回路”图(Figure3B and 3C)。然后,使用剩下的四个数据集生成的抑郁回路为每个受试者分配网络损伤评分(Figure 3)。每个受试者的网络损伤评分是通过累加抑郁回路中与该受试者病变重叠的体素的强度(T值)而得出的。
为了避免出现与阈值选择相关的偏差,使用无阈值的抑郁回路图计算网络损伤评分。为了规避病变大小和数据集不同的影响,进行回归分析,并提取残差来创建一个调整后的网络损伤得分,该得分用于所有分析。
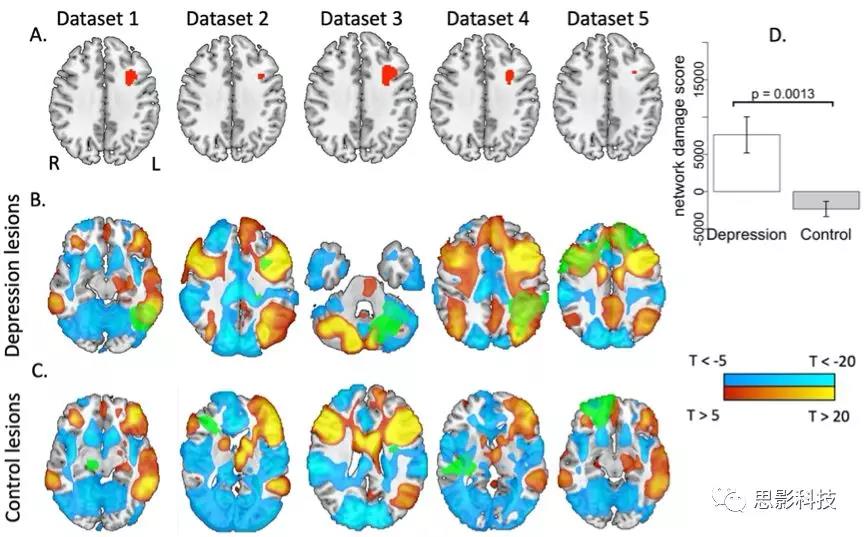
Figure 3. Lesion locations associated with depression intersect a brain circuitderived from independent lesion datasets.
与抑郁症相关的病变位置与源自独立病变数据集的相关脑回路。
(A)图2B所示的分析重复了5次,每次都排除5个数据集中的一个。在所有五项分析中,左侧背外侧前额叶皮层的一个区域与抑郁症患者病灶的联系明显多于与非抑郁症患者(红色表示;体素水平FWE校正p < 0.05)。
(B)和(C)这些区域与大脑其余部分的功能连接是使用1000名健康受试者的标准连接进行计算的,产生5个抑郁回路。红黄和蓝青色分别表示该区域的正连通性和负连通性(反相关),而绿色表示来自排除数据集的样本病变位置。为了便于可视化,抑郁回路在T =±5处阈值化(用于分析的实际抑郁回路未阈值化)。
(D)网络损伤评分(代表每个损伤与其他损伤数据集产生的抑郁回路的交集)在抑郁受试者中显著高于对照组
首先,作者检验了抑郁和对照组的网络损伤评分是否不同。其次,检查了网络损伤得分较高的受试者是否更容易患抑郁症。由于网络损伤评分的非正态性,这些分析的统计显著性是通过100万次的置换检验方法(permutation testing with one millionpermutations)来计算的。(非参数检验方法,可以用于非正态数据)
为了确保结果不过度依赖于用于定义对照和抑郁受试者的临界值,作者使用连续抑郁评分对整个受试者队列(N = 461)进行了附加分析。利用置换检验来确定由于这两个变量的非正态性是否引起的统计显著性,从而将该得分与网络损害得分进行Pearson相关分析。此外还检查了病灶大小是否在二元和连续抑郁模型中预测抑郁发生。
然后再将受试者分为三种风险类别:低风险(网络损害评分低于均值加减2个标准差)、高风险(网络损害评分高于均值加减2个标准差)和中等风险(其余受试者)。使用单因素方差分析比较不同风险类别的平均抑郁评分(Figure 4A)。最后,将轻度抑郁或可疑抑郁的受试者与对照组进行分组,并使用卡方检验评估抑郁患病率在三种风险类别中的差异(Figure 4B,因为作者这里的数据是个独立分类变量,所以使用了卡方检验)
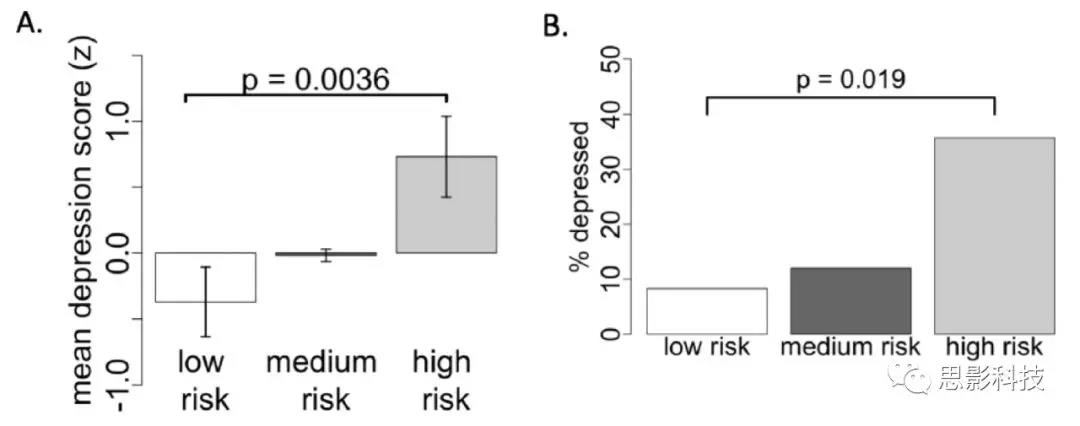
Figure
4.网络损伤评分与抑郁症的严重程度和患病率相关。
(A)所有受试者根据网络损伤评分分为三类风险。在不同的风险类别中,抑郁症的平均得分显著不同,在高风险组中最高。
(B)抑郁患病率在不同风险类别中存在显著差异,在高危组中最高。
卒中后抑郁治疗刺激目标
根据已有的研究结果,作者确定了已成功用于治疗中风后抑郁的经颅磁刺激靶点(见Supplementary Methods),并为每个TMS(经颅磁刺激)目标构建了12mm的锥体激活模型,并将其掩模在MNI标准脑脑中。作为对照,他们还构建了一个以顶点为中心的12mm圆锥体模型(相当于10/20脑电图系统中的Cz电极位置),该模型在经颅磁刺激试验中常用作为控制靶点,并被证明不能改善抑郁症。使用标准的连接体数据,作者评估了成功的TMS靶标是否与其在病灶网络映射分析中确定的种子区域有正相关的功能连接((‘LNM results’ in Figure 2B)。然后,使用Hotelling`st-test(用于多元统计检验)评估成功的TMS靶点与病变网络映射分析结果间的功能连接是否显著大于顶点(the vertex)
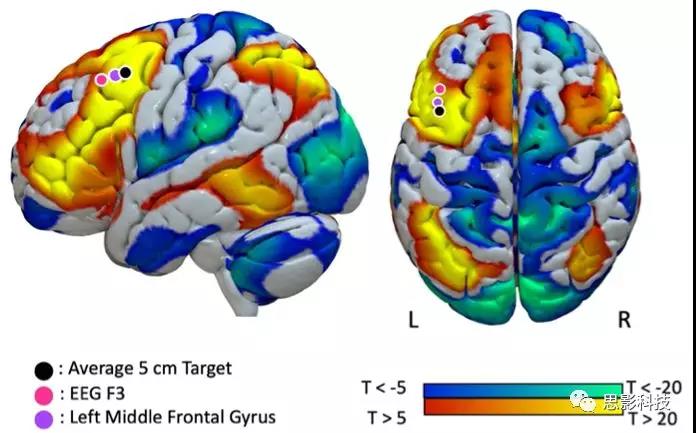
Figure 5.基于病灶位置的抑郁回路与用于治疗中风后抑郁的TMS部位保持一致。球体表示成功治愈中风后抑郁症的经颅磁刺激研究所使用的刺激位置。压抑回路显示在皮层表面上,并以T =±5为阈值,以便于可视化(不考虑实际网络的阈值)
结论:
对局部病灶的分析:
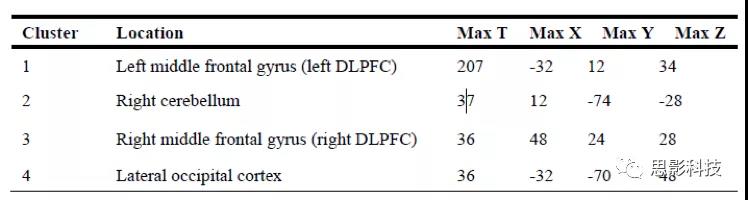
在5个数据集中(Table 1),与中度至重度抑郁相关的病灶和无抑郁相关的病灶发生在不同的大脑位置(Figure 1),与抑郁相关的58个病变中只有8个病灶位置重叠(Supplementary Figure S1A)。在合并数据时使用基于体素的损伤-症状映射,无论是在作者的DLPFC ROI中还是在整个大脑分析中,都没有损伤区域的体素与抑郁症显著相关(Supplementary Table S1, Figure 2A)。当抑郁作为一个连续变量(N =461)时,无论是在DLPFC ROI内部还是外部,也没有显著相关。
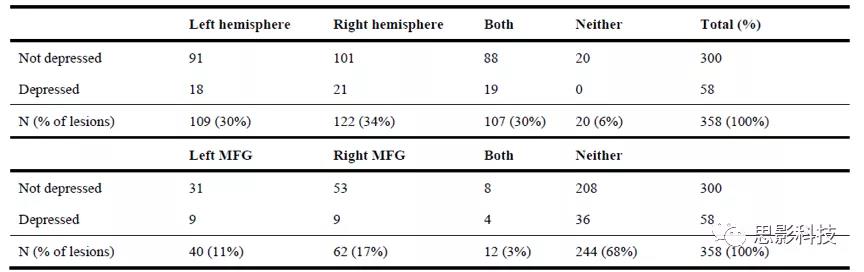
无论是重复以前文献中基于ROI的分析或进行单侧分析时(Supplementary Materials),病变位置与抑郁之间没有显著的相关性。左前和左后病变(p = 0.36)、左前和右前病变(p = 0.32)、右前与后病变(p = 1), 双侧背外侧前额叶与双侧腹内侧前额叶(p = 1),以及双侧背外侧前额叶和非前额叶病变(p = 0.76)间抑郁症的患病率没有差异。大脑左右半球的病变的抑郁患病率也无差异(p= 1),病变位于the Harvard Oxford left MFG 和 right MFG抑郁患病率也无差异(p = 0.44(SupplementaryTable S2)。
Supplementary Table S2.
局灶病变损伤的网络映射分析:
使用标准连接体计算每个病变位置与整个大脑之间的功能连接(Figure 2B)。与单纯关注病变部位的分析相比,病变脑网络的连通性与抑郁显著相关。具体来说,与非抑郁症患者相比,左侧DLPFC的一个局灶区域与抑郁症患者的病灶区域有更明显的联系(159个体素通过FWE校正,pc < 0.05)。左侧DLPFC区域峰值显著(p = 0.005),位于灰质交界处(MNI坐标:x = -32, y = 12, z = 36,Figure 2B)。这一结果与特定的DLPFC模板无关(Supplementary Figure S2),且在全脑分析中峰值仍显著(p <0.05)。除左DLPFC区域外,未发现其他显著点。
根据定义,用DLPFC区域的功能连接定义了一个脑回路,该回路包含与抑郁症相关的病变部位,同时避免与抑郁症无关的病变部位(Figure 2C; Supplementary Table S3)。来自抑郁症患者的病变位置与该回路有正相交,而来自非抑郁症患者的病变与该回路无相交。其他亚组如:出血性卒中(r =0.66)、缺血性卒中(r = 0.52)、穿透性创伤性脑损伤(r = 0.95)或患病前无抑郁记录(r = 0.53)时,在这种以病变区域为基础的抑郁回路上是相似的(Supplementary Figures S3 and S4)。
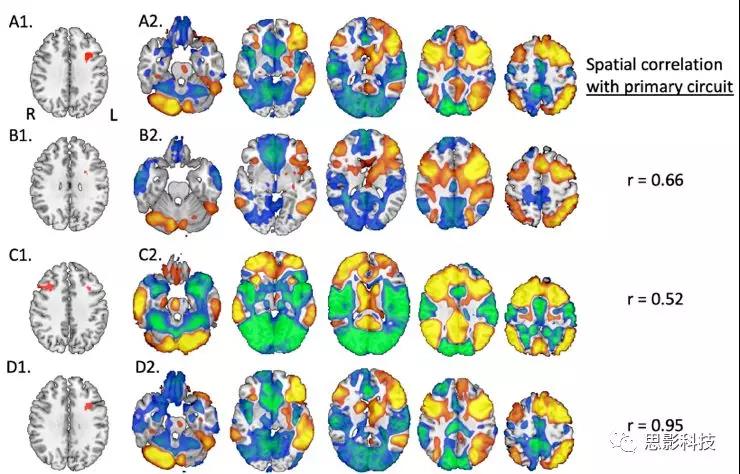
Supplementary Figure S3. Depression circuit compared towithin-etiology depression circuits.
A1. 初级分析中用来产生抑制回路的种子点。
A2. 初级抑郁回路产生利用病变的所有病灶 (N = 358).
B1. 用于产生出血性病变的抑制回路的种子点
B2. 出血性病变的抑制回路 (N = 52).
C1. 定义缺血性病变的抑郁回路的种子点
C2. 缺血性病变的抑郁回路(N = 162).
D1. 定义刺穿性脑损伤的抑郁回路的种子点.
D2. 刺穿性脑损伤的抑郁回路(N=144).
图中展示的MNI z = -25, -5, 15, 35, 55
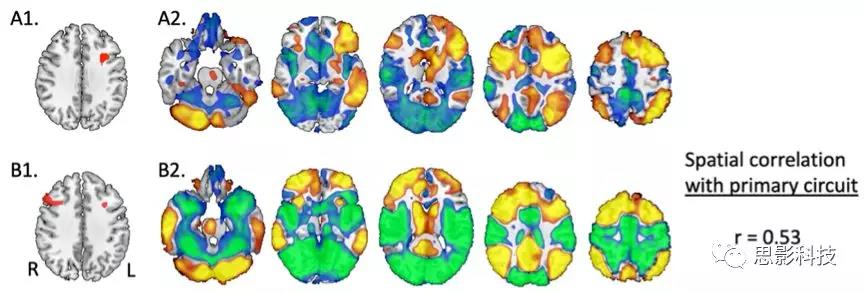
Supplementary Figure S4.与病变前无抑郁史的受试者(N=358人)相比(N=168人)结果图
留一交叉验证和网络损伤得分结果:
作为对可重复性的严格测试,作者重复了上述分析5次,每次排除一个数据集。无论排除哪个数据集,与抑郁相关的病变始终与左侧DLPFC的局灶区域相关性更强(p< 0.05)(Figure 3A)。与左DLPFC区域的网络连接定义了一个无论排除哪个数据集都相似的大脑回路(平均空间相关性r = 0.91,Figure3B, Supplementary Table S4)。与抑郁相关的病变位置与该回路的交叉程度明显大于对照组病变(p = 0.0013),这可以通过较高的网络损伤评分来证明。病变与该回路的交叉程度可以预测抑郁 (OR= 1.62, p = 0.0035)。病变大小不能单独预测抑郁(OR = 1.14, p = 0.31)。
SupplementaryTable S4
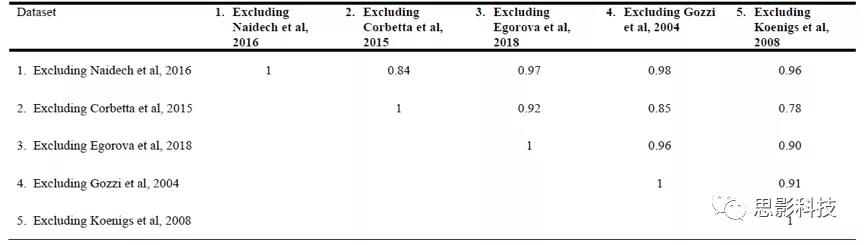
为了确保结果不依赖于将患者划分为“抑郁”或“不抑郁”的界限,作者对整个队列患者(n = 461)重复了对这一回路的分析,将抑郁视为一个连续变量,而不是一个二分类变量。与抑郁症回路的交集(使用其他四个数据集定义)仍是抑郁症严重程度的显著预测因子(r = 0.13, p = 0.0040)。仅病变大小不能预测持续抑郁的严重程度(r= 0.061, p = 0.19)。
将所有461名受试者根据回路交叉程度分为三种风险类别,发现抑郁评分(F(2,458) = 4.8, p = 0.0036,Figure 4A)和抑郁患病率(X2 = 7.2, p = 0.019,Figure 4B)有显著差异。抑郁症在高危人群(35.7%)中的患病率是低危人群(8.3)%的四倍。
卒中后抑郁治疗TMS(经颅磁)刺激目标:
作者确定了3个能有效治疗卒中后抑郁的TMS靶点(Figure 5),包括传统治疗原发性抑郁的5cm靶点、10/20脑电图坐标系下左侧F3电极位置和左侧MFG中心。所有三个靶点都位于抑郁回路内,该回路源于局灶性损伤位置,其定义为与左侧DLPFC节点的正连接((r = 0.23 for the 5 cm target, r = 0.14 for the EEG F3 target, andr = 0.20 for the center of the MFG, all p < 0.00001。三个TMS靶点与DLPFC节点的连接明显多于在顶点上的控制位置(all p < 0.0001)。
总结:
该研究结果定义了一个基于脑损伤部位的抑郁回路。以下为主要研究结果: 1、卒中位置与抑郁的发生没有显著的相关性。
2、病灶与左侧背外侧前额叶皮层(DLPFC)间的功能连接与卒中后抑郁的发生密切相关,而与病变病因、病变大小或数据集无关。
3、通过预测独立病变组的抑郁状态和抑郁严重程度来验证其提出的抑郁回路。
4、证明了其提出的抑郁回路来自于与抑郁相关的脑损伤,与改善抑郁症的脑刺激位点一致,表明了它的治疗效用。尽管作者在主要的分析中使用了二元界限,但是他们证明了结果并不依赖于这些界限,并且在将抑郁作为连续变量时是可重复的。
原文:
A Human Depression Circuit Derived From Focal Brain Lesions
JL Padmanabhan, D Cooke, J Joutsa, SH Siddiqi…- Biological…, 2019 - Elsevier

微信扫码或者长按选择识别关注思影
第十四届磁共振脑网络数据处理班(重庆,7.26-31)
第三十届磁共振脑影像基础班(南京,7.31-8.5)
第十届脑影像机器学习班(南京,6.30-7.5)
第十二届磁共振弥散张量成像数据处理班(南京,6.18-23)
第二十届脑电数据处理中级班(重庆,8.9-14)
如对思影课程感兴趣也可微信号siyingyxf或18983979082咨询。觉得有帮助,给个转发,或许身边的朋友正需要。请直接点击下文文字即可浏览思影科技其他课程及数据处理服务,欢迎报名与咨询,目前全部课程均开放报名,报名后我们会第一时间联系,并保留名额。
小动物磁共振脑影像数据处理班(预报名,南京)
第二十一届脑电数据处理中级班(南京,9.7-12)
第七届眼动数据处理班(南京,7.26-30)
脑电信号数据处理提高班(预报名)
脑磁图(MEG)数据处理学习班(预报名)
思影科技功能磁共振(fMRI)数据处理业务
思影科技弥散加权成像(DWI/dMRI)数据处理
思影科技脑结构磁共振成像数据处理业务(T1)
思影数据处理业务三:ASL数据处理
思影科技脑电机器学习数据处理业务
思影数据处理服务五:近红外脑功能数据处理
思影数据处理服务六:脑磁图(MEG)数据处理
招聘:脑影像数据处理工程师(重庆&南京)
BIOSEMI脑电系统介绍
目镜式功能磁共振刺激系统介绍