原发性脑肿瘤的自然病史和预后因原发性或继发性胶质瘤的不同肿瘤行为(低级别病变的高级别转化)以及MRI上确定影像性坏死、肿瘤进展和假性进展的困境而变得复杂。影像组学和影像基因组学有望提供精确诊断、预测预后,并评估肿瘤对现代化疗、免疫治疗和影像治疗的反应。这是通过形态学、纹理和功能特征的三位一体实现的,这些定量体素级的高通量特征来自对MR图像提取。然而,采集参数缺乏标准化,研究之间的方法不一致,使得验证不可靠,因此,涉及异质研究人群的多中心研究是有必要的。本文阐明了新的影像和影像基因组学工作流程,以及MR图像预处理中最先进的方法,以及有关此类机器学习技术在脑胶质瘤管理中应用的研究。本文发表在British Journal of Cancer杂志。(可添加微信号siyingyxf或18983979082获取原文,另思影提供免费文献下载服务,如需要也可添加此微信号入群,原文也会在群里发布)。思影曾做过多期关于影像组学的文章解读,欢迎点击下文浏览:
Radiology:影像组学:图像不仅仅是图片,它们还是数据
Radiology:图像生物标志物标准化:基于高通量图像表型的标准化定量影像组学
IEEE Signal Processing Magazine:从手工放射组学特征到深
Radiology:脑部MRI影像组学:转移瘤类型预测的应用
Neuro-Oncology:对脑胶质瘤IDH突变状态进行分类的一种新型的
Neuro-Oncology:深度学习算法全自动评估脑胶质瘤负荷
Lancet Oncology:利用人工神经网络对神经肿瘤学MRI成像进行
Radiology:人工智能系统脑MRI鉴别诊断精度接近神经放射科
背景
在美国,原发性脑肿瘤约占所有癌症的2%,发病率约为23/100000。胶质瘤占所有恶性脑肿瘤的80.6%。胶质母细胞瘤的发病率最高(每10万人中有3.21人),其次是弥漫性星形细胞瘤(每10万人中有0.46人)。年龄调整后的死亡率为4.4/100000,5年生存率为35%。然而,由于诊断时的年龄和肿瘤的组织学特点,生存和死亡率显著变化。
2016年,我们对胶质瘤分子发病机制的理解进展促使世界卫生组织(WHO)对中枢神经系统(CNS)肿瘤的分类发生了重大变化。以前,分类标准仅基于微观特征。新标准对某些肿瘤中包含遗传信息的实体进行了重新分类。由于遗传因素对肿瘤发生和后续治疗的影响,这些变化被纳入。
在当今的现代成像时代,准确无创地预测胶质瘤的级别/类型、生存率和治疗反应仍然具有挑战性。虽然立体定向活检具有侵入性且成本高昂,但仍然是组织学和遗传学分类的参考标准;然而,在7%-15%的患者中,病理诊断可能仍然不确定。这就需要成像标志物来描述肿瘤的异质性。最近,多项研究表明,多参数磁共振成像(MRI)的形态学特征与生存率之间存在密切联系。同样地,功能成像技术如灌注加权MRI和磁共振波谱(MRS)与形态学特征一起使用时,已被证明是有效的,但成功率和再现性有限。当前成像技术的局限性为更复杂的亚视觉特征分析提供了机会,以增强形态学特征和当前功能成像的能力。
影像组学是指通过计算机从影像图像中提取可量化数据,其形式为通常为亚视觉的影像图像特征。这些提取的数据在影像学图像中创建了可挖掘的数据库,可用于诊断、预后特征描述,以及评估或预测对某些疗法的反应。基因突变通常决定肿瘤的侵袭性,并已被证明与病变的生长模式和治疗反应有关。影像特征已被证明可以识别肿瘤DNA和RNA中的基因组改变。对来自影像学和基因组的数据的综合研究被称为影像基因组学。在这篇综述中,我们从神经影像学家、神经外科医生和神经肿瘤学家的角度描述了影像组学和影像基因组学的应用。具体来说,我们回顾了一些工作,这些工作强调了在诊断和预测不同类型脑肿瘤患者预后方面不断发展的重要性。此外,我们还讨论了将这些方法集成到影像工作流程中以改善患者护理和预后的潜力和重要性。
影像组学是一个新兴的领域,涉及以高通量方式将影像影像图像转换为高维的可挖掘的数据。这个多步骤过程包括:(a)图像采集和重建,(b)图像预处理,(c)感兴趣区域的分割,(d)特征提取和量化,(e)特征选择,以及(f)使用机器学习建立预测和预测模型(图1)。
为了解释MRI强度的不均匀性、不同中心扫描仪的可变性,特征提取前需要进行图像预处理方法(例如强度归一化、体素强度校准和偏置场校正)。感兴趣区域(ROI)的分割可以通过手动、半自动或全自动方法实现。然后从已分割的ROI中提取影像组学特征。常见特征可分为以下几组:形态特征、纹理特征和功能特征。
在特征提取之后,使用不同的统计方法来选择与预期结果相关的显著特征子集。常用的特征选择算法包括:最小冗余最大相关(mRMR)算法和排序特征选择方法。进行特征选择是为了减少与高维特征集相关的潜在模型过度拟合。一旦确定了显著特征,机器学习分类器和其他统计方法(如Cox比例风险建模技术)将用于建立预测和预后模型。“影像组学质量评分”工具,用于评估与肿瘤生物学相关的影像组学研究的质量;然而,这些分数结果的可解释性仍然值得怀疑。
最近影像基因组学的出现也加速了多组学数据的整合,以实现准确诊断和改进个性化癌症治疗。神经肿瘤学影像基因组学的第一步(图1)是通过新鲜冷冻石蜡包埋(FFPE)样本或从脑肿瘤内立体定向脑活检获得的组织微阵列(TMA)样本获取基因组材料。其次,测序等生物信息学技术可以检测单基因突变。例如,表皮生长因子受体(EGFR)扩增、O6甲基鸟嘌呤甲基转移酶(MGMT)甲基化可以通过免疫组织化学(IHC)分析和下一代测序(NGS)技术(如mRNA测序)来检测蛋白质。mRNA测序、全外显子组测序和全基因组测序有助于检测多基因表达异常。影像基因组分析的决定性目标是将基因突变和通路与不同的影像学表型直接联系起来。
形态学影像学特征用于量化增生边界引起的病变浸润。这些特征可以进一步分为全局形态特征和局部形态特征。全局特征通过提取测量值(如圆度、周长、长轴和短轴直径以及延伸系数)来描述病变轮廓。局部形态特征表征了从等值面导出的曲面曲率属性。这些包括定量测量,如曲率(弯曲度)和锐度。
结构方法通过识别结构特点及其排列规则来描述纹理。Gabor滤波器等多尺度、多分辨率可控带通滤波器是应用最广泛的基于方向的结构描述符。通过将原始图像分解为多个频率和方向的正弦波的滤波器响应,对Gabor描述符进行建模,以模拟人类视觉系统解码对象外观的方式。正如Doyle等人所证明的那样,Gabor过滤器可以在组织学样本上区分病理学特征。
统计方法通过计算每个图像点的局部特征,并从局部特征的分布中导出一组统计数据,来分析灰度值的空间分布。用于识别基于形状的对象类的一种常用统计技术是方向梯度直方图(HOG)。传统上,HOG的适用性已被证明适用于检测杂乱图像中的人体形态。多坐标HOG可以在高分辨率断层图像中区分不同类别的肺组织。它通过计算局部强度梯度的分布来描述局部对象的外观和形状。灰度共生矩阵(GLCM)功能通常被称为Haralick功能,最初设计用于航空摄影,利用距离和角度值进行灰度组合。
结构和统计结合进行纹理特征分析
局部二元模式(LBP)是一种纹理算子,它将统计和结构方法结合在外观分类中。LBP对于因患者运动伪影而影响的图像具有鲁棒性。该特征将纹理信息表示为中心像素及其相邻像素强度的联合分布。Li等人展示了LBP和神经网络在内窥镜图像分类中的应用。结合统计和结构技术的另一个特征是局部各向异性梯度方向(CoLlAGe)描述符,该描述符试图捕获和利用体素水平梯度方向中的局部各向异性差异来区分相似的表现型。
传统影像特征临床应用的一个关键障碍是其生物学解释性低。作为生物标志物,属性不仅应该是可测量和可复制的,而且还应该反映潜在的解剖或生理学意义。迫切需要发现与生物学相关的影像特征。功能性影像标记物是一类新的标记物,通过模拟直接捕捉血管生成等潜在生理特性的特征,专门针对“可解释性”问题。为病变供血的血管的特性(如卷曲度、密度)在药物的最终反应中起着重要作用。最近,基于扭曲度的特征捕捉血管网络排列中的局部和全局紊乱已被证明在诊断和治疗反应评估中是有效的。形变描述符是另一类功能性影像组学标记物,旨在测量由于质量效应而导致的脑实质组织变形。这些特征提供了对可见手术边缘外微环境的洞察。
血管构筑成像(VAI)MRI是一种无创测量参数以描述脑微血管结构异质性的技术。根据血管的结构和生理特性,不同的梯度回波(GE)和自旋回波(SE)图像在MRI读数中产生明显不同的变化。Stadlbauer等人使用血管构筑图(VAM)评估了胶质瘤(n=60)。他们引入了三种新的VAM生物标记物:(i)微血管类型指示物(MTI),(ii)血管诱导的团注峰值时间偏移(VIPS),以及(iii)曲率(Curv)和适应已知参数、微血管半径(RU)和密度(NU)。MTI和VIPS参数有助于检测新生血管,尤其是HGGs(高级别神经胶质瘤)肿瘤核心的新生血管,而曲率显示瘤周血管源性水肿,与HGG肿瘤核心的新生血管相关。这些生物标记物可以深入了解胶质瘤血管变化的复杂性和异质性,从而区分HGG和LGG。此外,将多参数定量血氧水平依赖性方法(qBOLD)与VAM参数相结合,有助于区分LGGs和HGGs,并以更高的灵敏度识别异柠檬酸脱氢酶(IDH)突变状态。Stadlbauer等人还结合VAM生物标记物对血管滞后环(VHLs)进行了分析,以评估胶质母细胞瘤对抗血管生成治疗的反应。MTI被发现有助于预测有反应区域和无反应区域,而Curv更适合评估血管源性水肿的严重程度。Price等人使用弥散张量成像(DTI)结合MR灌注和MRS成像来确定胶质母细胞瘤侵袭性和非侵袭性边缘的变化,以更好地预测治疗效果和总体生存率。
语义特征,如肿瘤位置、形状和结构MRI上的几何特征,是神经影像学家用来描述肿瘤环境的定性特征。以往的研究发现,语义特征与脑肿瘤的遗传表型有关。TCIA的视觉可访问伦勃朗图像(VASARI)项目建立了一个特征集,以便使用一组定义的视觉特征和受控词汇对胶质瘤进行一致的描述。研究表明,这些特征具有高度的可重复性,为胶质母细胞瘤的治疗提供了有意义的指导。语义特征对图像采集参数和噪声的变化也具有鲁棒性,可以与机器学习环境中更复杂的影像特征一起使用。
许多研究表明,织构分析可用于区分HGG和LGG。Skogen等人。应用过滤直方图技术描述肿瘤异质性。在95名患者(27名II级、34名III级和34名IV级)的队列中,通过使用精细结构量表的标准差(SD),他们能够区分LGG和HGG,其敏感性和特异性分别为93%和81%(AUC 0.91,P<0.0001)。Tian59等人对153名患者的多参数MRI进行了纹理分析,并报告使用SVM分类器对LGG和HGG进行分类的准确率为96.8%,对III级和IV级进行分类的准确率为98.1%。Xie等人评估了42例胶质瘤患者动态增强磁共振((DCE)-MRI)的五种GLCM特征。他们报告说,熵(AUC=0.885)和IDM(AUC=0.901)分别能够区分III级和IV级胶质瘤,以及II级和III级胶质瘤。
Suh等人使用基于MRI影像组学的机器学习算法来区分中枢神经系统淋巴瘤(PCNSL;n=54)和非坏死性非典型胶质母细胞瘤(n=23)。首次获得了6000多个多序列和多区域的影像特征,包括形状、体积和纹理。AUCs在所使用的三台机器中均具有统计学意义,表明其诊断性能高于三名影像科医生。
与IDH1野生型成人LGG(即IDH1突变阴性)相比,具有IDH1突变的成人LGG具有更好的预后和更长的生存期,后者的作用更为积极。1p/19q编码缺失与化疗反应良好和预后良好有关。无创性影像基因分子分型可用于LGG的个性化治疗决策。
多个研究小组评估了影像组学特征,以确定胶质瘤的分子表型。Zhang等人使用SVM递归特征消除(SVM-RFE)提取了15个最佳影像组学特征(n=152),该特征可以检测IDH突变精度达到82.2%。Han等人从42例经组织病理学证实的胶质瘤患者中提取影像特征。他们发现,来自T1加权图像(T1WI)、T2加权图像(T2WI)和对比增强T1WI成像直方图和GLCM特征的变量可用于检测IDH1突变的胶质瘤。联合变量T1WI+C预测IDH1突变的AUC为0.984,联合变量T1WI预测IDH1突变的AUC为0.927。Jakola等人报告说,结构同质性可以区分IDH突变型LGG患者和IDH野生型LGG患者(P=0.005)。用于预测IDH突变的组合参数(肿瘤同质性和肿瘤体积)的AUC为0.940。然而,这种方法不能区分有或没有1p19q编码缺失的IDH突变LGG。Bahrami等人测量了61名患者的FLAIR图像上的组织异质性和边缘对比度(EC),并报告称,与IDH突变型相比,IDH野生型肿瘤患者表现出更高的信号异质性(P=0.001)和更低的EC(P=0.008)。在IDH突变肿瘤患者中,1p/19q编码的肿瘤具有更大的信号异质性(P=0.002)和更低的EC(P=0.005),MGM甲基化肿瘤显示更低的EC(P=0.03)。
D-2-羟基戊二酸(D-2HG)产生的代谢改变是胶质瘤IDH突变的标志。最近,许多研究小组已经证明使用1H-MRS检测D-2HG是可靠的。Andronesi等人报道了使用2D相关光谱(COSY)和J-差分光谱在IDH1突变的胶质瘤中检测D-2HG的明显活体检测。Rohle等人通过高通量筛选确定了一种选择性R132H-IDH1抑制剂,该抑制剂可以以剂量依赖性的方式抑制R-2HG的产生,为靶向治疗提供了另一种新的途径。
胶质母细胞瘤治疗中的一个主要挑战是,难以准确评估对几种实体治疗的反应,这些实体可以在结构MRI上模拟肿瘤复发或进展,即假进展和影像性坏死(RN)。视觉诊断往往模棱两可,临床上仍极具挑战性。功能性MRI,如MR灌注和MRS,提高了诊断准确性;然而,这可能不是普遍可用的,而且通常很难复制。影像组学提供了一种非侵入性方法,可以可靠地将肿瘤复发与治疗效果区分开来,并可能有助于防止不必要的活检。
通过结合从T1WI增强病变和T2WI\/FLAIR高信号病灶周围区域提取的3D形状和表面影像特征,Ismail等人能够以90.2%的准确率区分真进展和假进展(n=105)。两个最具辨别力的特征被发现是局部特征,捕捉增强病变的总曲率和T2WI\/FLAIR高信号瘤周区域的曲率。这种差异表达模式可能是由于通过渗透改变白质结构,导致表面形状不规则。
与假进展类似,由于缺乏客观的评估方法,在常规MRI上区分脑肿瘤复发(RT)和放射学坏死(RN)可能具有挑战性。Larroza等人提出的纹理分析基于支持向量机方法可以区分转移和坏死(n=115),AUC>0.9。CoLlAGe特征在不同分级的坏死和肿瘤中表现不同。与单纯的脑RN或脑部主要肿瘤区域RN相比,主要肿瘤部位偏向更高的CoLlAGe熵值。与单独使用来自主要肿瘤部位RN/RT的特征相比,训练集中来自单纯脑部RN的CoLlAGe特征提高了主要RN/RT的分类性能。这可能在一定程度上证明了单纯脑部RN与其混合特征呈现在结构和形态特性上的相似性。病例(RT=15,RN=16,n=31)的平均AUC为0.94。有趣的是,使用ADC特征的性能明显优于使用常规MRI测量的性能。将异质性的结构测量与示踪剂摄取动力学相结合,可以更有效地区分脑转移复发和影像性损伤。使用18F-FET摄取的肿瘤脑比(TBR)诊断准确率为83%,结合粗糙度、短区强调或相关性等纹理参数,诊断准确率提高到85%。这显示了纹理属性可能与其他模式一起提供的潜在补充诊断信息。
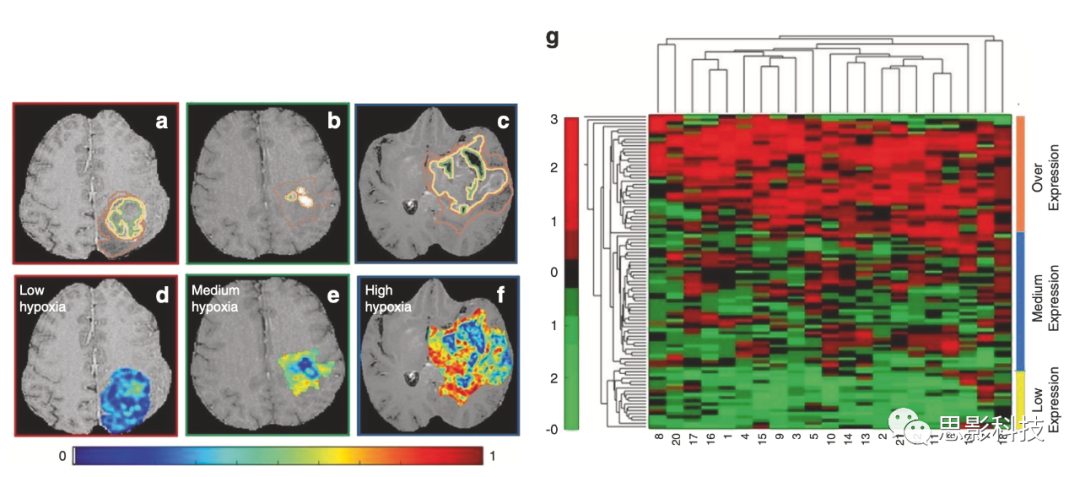
超过40%的胶质母细胞瘤患者对常规放化疗无效,并在6-9个月内出现进展。多形性胶质母细胞瘤中的缺氧是已知的促进肿瘤新生血管和健康组织侵袭的关键途径,并导致治疗抵抗,导致预后不良。众所周知,细胞增殖、凋亡和血管生成增加等多种途径也会导致无进展生存(PFS)不良结果。目前,缺乏有效的生物标志物来监测缺氧水平,并预测抗血管生成药物的治疗反应。Beig等人表明,替代影像描述符可以在治疗前MRI上捕捉胶质母细胞瘤的缺氧程度,并预测生存率(图2)。本研究中,作者利用缺氧患者的脑胶质母细胞表达谱构建了85个脑胶质母细胞表达谱。接下来,训练与高缺氧富集评分(HES)相关的影像组学模型,然后根据胶质母细胞瘤的总体生存率(OS)对其进行分级。在n=30名患者的验证集上,与HES密切相关的影像组学特征也可以区分短期幸存者(OS<7个月)和长期幸存者(OS>16个月)(P=0.003)。Kickingereder等人(n=119)的另一项研究提取了超过12190个胶质母细胞瘤的影像组学特征,并得出结论,11个显著特征的影像特征可以预测PFS和OS。
图2,缺氧富集评分的构建。
a–c显示了三名不同GBM患者的2D Gd-T1w MRI切片,分别显示低、中、高缺氧富集评分(HES),其中有专家注释的坏死(绿色轮廓)、增强肿瘤(黄色)和水肿区域(棕色)。对于HESlow(d)、Hesmidum(e)和Heshigh(f),相应的反向差分矩(Haralick)特征图已覆盖在手动注释的肿瘤区域上; g来自21个缺氧相关基因的RNAseq数据的无监督聚类分为高缺氧(海蓝显示为Heshigh)、中等缺氧(海蓝显示为Hesmidum)和低缺氧(黄色显示为Heslow)。
聚类图中的x轴代表21个基因,y轴代表97个GBM病例的患者群体。
Jain等人研究了在多序列增强MRI上从胶质母细胞瘤非增强区(NER)获得的成像、基因组和血流动力学参数。研究发现,NER(rCBVNER)和穿过中线的NER的相对脑血容量增加与生存率低有关。野生型EGFR突变是唯一与rCBVNER高的患者生存率显著低下相关的基因组改变。
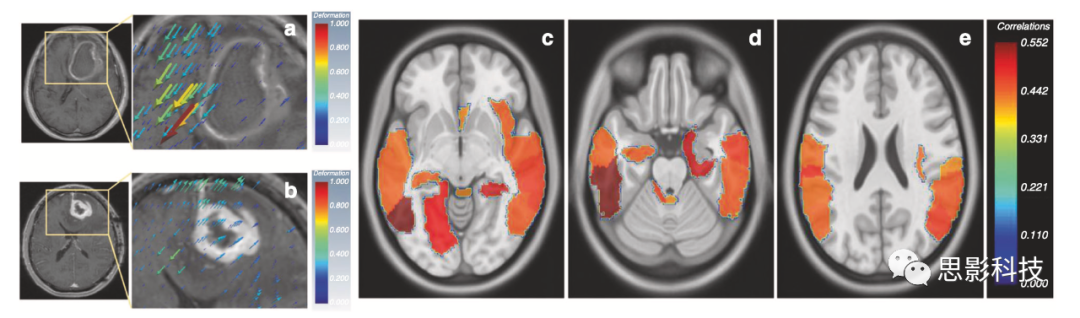
Prasanna等人讨论了多序列MRI上胶质母细胞瘤的质量效应诱导变形异质性(MEDH)如何影响生存率。MEDH在语言理解、社会认知、视觉感知、情绪、体感、认知和运动控制功能等领域的高表达被发现与较差的生存率相关(图3)。McGarry等人能够使用新诊断的胶质母细胞瘤的多序列MRI影像图谱(RPs),以进一步分层患者预后。每个检查的体素都分配了一个RP。五个这样的RP可以预测治疗开始前的总体生存率。
图3,形变影像组学
a、 b代表组织位移的变形向量显示为叠加在右半球GBM图像切片上的体积渲染3D抖动。变形量与抖动体积的大小成正比。变形量的较大值分别用“红色”表示,较小值用“蓝色”表示。震颤还显示组织移位的方向。
c 右半球肿瘤组的AAL区域,MEDH与生存率呈负相关,P<0.05(神经系统视图)。颜色贴图显示负相关值(显示为正以便于表示)。
低级别胶质瘤的生存分级
Liu等人开发了一种用于预测LGG中PFS的影像组学特征。计算影像风险评分(RRS),并通过影像基因分析确定高风险评分组的遗传特征。细胞粘附、细胞增殖、分化和血管生成的生物学过程与RRS呈正相关。将RRS与其他临床特征相结合的列线图改善了患者分层,并导致更好地评估PFS。
Zhou等人利用自动纹理分析和VASARI特征建立了影像组学模型,以预测弥漫性中低级别胶质瘤患者(n=165)的IDH1突变(AUC=0.86)、1p/19q编码缺失状态(AUC=0.96)、组织学分级(AUC=0.86)和肿瘤进展(AUC=0.80)。他们发现,在MRI图像上,没有增强和平滑无增强的边缘可以预测更长的PFS;光滑非增强也是LGG更长PSF的一个重要预测因素。
Li等人选择了九种可以预测Ki-67表达水平的影像组学特征,在训练(n=78)和验证(n=39)集的准确率分别为83.6%和88.6%。在高SDp组患者中,只有球形不均衡(SDp)特征被发现是一个显著的预后因素。在多变量Cox回归分析中,Ki67表达水平和SDp是独立的预后因素。
抗血管生成治疗是复发性胶质母细胞瘤的首选治疗方法。Kickingereder等人研究了可能可以预测治疗结果的影像标志物。在贝伐单抗抗血管生成治疗之前,利用复发性胶质母细胞瘤的多序列MRI,提取并分析了172例患者的磁共振图像的影像组学特征。利用这些影像组学特征,建立了一个模型来预测低风险和高风险人群中的全氟辛烷磺酸和全氟辛烷磺酸的中位数。作者得出结论,影像组学可能能够确定贝伐单抗治疗最有益的患者。
Bahrami等人在贝伐单抗治疗开始前后对33名HGG患者进行了评估。他们在FLAIR高信号区域内分割感兴趣体积(VOI),并使用3D-FLAIR图像的梯度提取每个VOI的边缘对比度(EC)大小。他们报告说,FLAIR高信号区的EC较低与PFS(P=0.009)和OS(P=0.022)较差有关。
传统的结构MRI虽然作为一种普遍可用的成像方式很受欢迎,但通常无法用增强、肿块效应和病灶周围水肿等经典标准区分肿瘤复发、假性进展和影像性坏死。文献中所描述的某些增强模式如“瑞士奶酪(Swiss cheese)”、“肥皂泡(soap bubble)”或“切青椒(cut green pepper)”最初被认为有利于影像性坏死的诊断,但它们只有25%的阳性预测值,被认为是治疗诱导的,但它们缺乏再现性,需要进一步的纹理分析、光谱或血流研究进行验证。进展检测、假进展检测和混合病变检测的困境和延迟可能会延迟治疗或导致治疗中断。
目前,立体定向脑活检仍是组织学和遗传学分类的金标准。然而,胶质瘤的高度异质性可能会降低活检的准确性,并使约7–15%的患者的病理诊断不确定。基于潜在基因型评估肿瘤局部影像表现的能力可能会减轻活检过程中与组织取样相关的偏差。影像分析非侵入性区分胶质瘤分子亚型的潜力不仅可以提供额外的预后信息,还将有助于选择多基因突变和潜在高级别肿瘤类型患者的靶向化疗。
胶质母细胞瘤手术去瘤的中位生存期为15个月,临床结果取决于初始切除的程度和对化疗放疗的反应。因此,可以利用影像组学风险模型更好地预测治疗反应、全氟辛烷磺酸和全氟辛烷磺酸。通过非侵入性获取肿瘤的影像基因图谱,可以评估抗血管生成疗法(如贝伐单抗)的效果,而不会对患者造成伤害。迄今为止,抗血管生成治疗的疗效主要通过MRI和MRS进行监测。抗血管生成治疗影响肿瘤的假进展,因为在服用抗血管生成药物后,肿瘤的标准增强特征可能会假性降低。对比剂增强和血管源性水肿的快速减少表明,当肿瘤可能稳定或进展时,会出现抗血管生成反应。抗血管生成治疗后肿瘤MR特征的改变主要与血脑屏障通透性的改变有关。通过在这种情况下使用影像组学,可以监测实际的肿瘤反应,并在肿瘤进展之前进一步调整治疗策略。
胶质瘤在基因上具有高度异质性。广泛的基因改变,加上微环境生物化学,在大体组织学和影像学上出现特征性表现。除了在IDH、MGMT和EGFR差异的董事会背景下审查的工作外,其他关联也得到了支持。对比增强已经证明与缺氧-血管生成通路相关的基因,如血管内皮生长因子(VEGF)。捕捉内囊异常强度的影像组学特征已被证明与MYC癌基因表达相关。有趣的是,多个影像基因相关实验揭示了成像表型与细胞外基质破坏、细胞侵袭和代谢相关的通路之间的强烈关联。
此外,影像组学提供了一个机会,可以对完整的肿瘤进行分析,从而减轻采样误差的限制,以及由于缺乏肿瘤样本,神经病理学家无法进行完整的分子和组织病理学评估。通过定量突变值而非二元命名,影像组学可以帮助神经肿瘤学家和神经外科医生做出个性化的治疗决策,并可靠地预测治疗反应。
限制影像量的一个主要特征是,由于缺乏标准化采集参数和研究方法,可变性和缺少一致性导致的再现性差。在不同的数据集上测试时,辐射特征的准确性通常会有所不同。已有多项研究探讨了不同采集参数对纹理分析的影响。磁强度、翻转角度、不同的空间/矩阵大小、T1WI和T2WI中的TR/TE变化以及不同的扫描仪平台都会影响纹理特征。Molina等人发现,在动态范围变化下,没有纹理度量是稳健的,在空间分辨率变化下,熵是唯一稳健的特征。Buch等人得出结论,一些特征更为稳健,一些特征更容易受到不同采集参数的影响,因此需要使用标准化的MRI技术进行纹理分析。此外,纹理分析软件可用性的变化增加了标准化和再现性的复杂性。多个研究使用了不同算法的软件,使得这些研究的再现性和可重复性几乎不可能。需要进一步的研究来评估不同类型软件结果的准确性,以帮助标准化。
缺乏针对特定临床领域的带注释的影像学研究的公开数据库,限制了研究人员进行大样本研究的能力。小样本量和大量预测变量通常会导致过度拟合,这是机器学习模型的一个主要限制。为防止过度拟合,建议样本量比分析变量大6-10倍,或仅使用几个预选的稳健变量进行分析。研究型大学之间需要合作,为更大的队列研究创建专业注释的标准化数据集,这些数据集可以分为训练、测试和验证数据集,以避免过度拟合。这也将允许研究人员在外部队列上测试他们的算法,并验证他们的解决方案的稳健性。实现这一目标的一个最新进展是使用联邦学习,这有助于多机构验证机器学习模型,而无需使用分布式框架显式共享数据。
为特征提取选择适当感兴趣区域的可变性可能会影响某些影像组学属性,例如基于形状的度量。目前没有针对影像科医生报告定量成像特征的指南,这使得现有的大型图像存储库无法用于治疗。为了生成具有分段和注释的适当感兴趣区域的高质量数据,影像科医生需要成为数据量化和整理的组成部分。
缺乏常规获取的基因表达谱和组织取样误差限制了基因表达谱的应用。单个研究所很难创建一个包含辅助数据的大型影像数据库,如基因组图谱、人口统计学、治疗信息及其结果。癌症基因组图谱(TCGA)公开了癌症数据集,并提供了全面的基因组图谱目录,以解决这一问题。影像基因组学的临床翻译也受到特定脑肿瘤内空间和时间异质性的阻碍。然而,影像组学对完整肿瘤进行分析的能力可能会解决这一局限性。
促进自动特征学习的深度学习算法最近在从肿瘤分割到生存预测的任务中显示出巨大的前景。方法结合影像学和病理学数据将胶质瘤分为少突胶质细胞瘤和星形细胞瘤。然而,这种方法除了通常缺乏透明度和可解释性外,还需要用于训练的大型数据集。深度学习网络在医学成像领域的不确定性和可解释性是一个灵活的研究领域。作为临床决策支持系统,影像组学和深度学习算法转化为临床工作流程的一个重大挑战来自监管角度。美国食品和药物管理局(FDA)严格监管依赖机器学习和模式识别技术的CAD(计算机辅助检测)系统;机器学习模式带来了新的监管挑战,需要为寻求批准的提交提供专门指导(https://www.fda.gov/medical-devices/software-medical-device-samd/artificial-intelligence-and-machine-learning-software-medical-device )。此外,新的人工智能模型即使在上市后仍在不断发展,因为它们暴露于更多的数据中。必须在特定的时间间隔内采用定期测试要求,以确保这些模型的自适应变化符合预测。
最近的倡议,如图像生物标记物标准化倡议,根据在影像组学模型上获得的结果提出了某些指导方针。测试-重新测试实验设置也被广泛提议,以便于选择稳定和可靠的影像测量方法。在第一批此类研究中,CT影像组学的可重复性是在“茶歇”测试中确定的,即在15分钟的时间间隔内从同一台扫描仪获得扫描,然后重新测试。类似的设置也适用于脑成像,以确定适合临床应用的影像组学特征。癌症成像档案馆保存了从多个机构获得的脑肿瘤集合(HGG和LGG)以及其他癌症的成像数据集。这些数据集已被研究界广泛用于开发和验证影像组学和影像基因组学工具。
几乎所有回顾性影像遗传学研究中的一个明显缺陷是缺乏关于活检样本相对于患者图像像素位置的信息。影像定位活检和随后的影像病理学联合配准是缓解与MRI上定位活检区域相关的偏差的必要步骤。Hu等人之前曾将MRI扫描和相应的纹理图与活检位置联合配准,以研究具有空间匹配成像描述符的区域遗传变异。在后续研究中,Hu等人提出了一种基于高斯过程和传递学习的概率模型,用于量化影像基因组流程中的空间不确定性。影像基因组模型中真实标签的稀疏可用性可以被建模为“弱监督”或“不完全监督”任务。可以实现多实例学习技术来解决这个限制。
影像学领域有望通过实现客观的肿瘤特征来提升医学成像的作用。在肿瘤学中,影像组学可以通过生物标记物的利用进行非侵入评估肿瘤的预后信息。在神经外科,它可以用于改进术前和术后的治疗计划。新兴公司现在正在提供软件,通过PACS查看系统提供基于网络的影像组学分析。来自美国影像学院等学术机构的支持正在增加。这些努力很容易促进影像医学研究向临床实践的过渡。
影像组学的目的不是在未来取代影像科医生,而是以更高的精确度改进疾病诊断和特征描述。神经影像学、神经外科学和神经肿瘤学的未来必须结合利用影像组学和影像基因组学的进展,以提供少侵入性和肿瘤特异性较小的精确治疗策略,并最终优化患者护理。为了使这一领域继续发展并进入临床实践,开发更加标准化和可复制的数据解释方法、维护可公开获取的影像研究数据库以及进行前瞻性大规模多机构临床试验至关重要。在未来,影像组学和影像基因组学领域有望提高现有成像模式的效用,并将其引导至个性化医疗。
如需原文及补充材料请添加思影科技微信:siyingyxf或18983979082获取,如对思影课程及服务感兴趣也可加此微信号咨询。另思影提供免费文献下载服务,如需要也可添加此微信号入群,原文也会在群里发布,如果我们的解读对您的研究有帮助,请给个转发支持以及右下角点击一下在看,是对思影科技的支持,感谢!
微信扫码或者长按选择识别关注思影非常感谢转发支持与推荐
欢迎浏览思影的数据处理业务及课程介绍。(请直接点击下文文字即可浏览思影科技所有的课程,欢迎添加微信号siyingyxf或18983979082进行咨询,所有课程均开放报名,报名后我们会第一时间联系,并保留已报名学员名额):
核磁:
北京:
重庆:
南京:
上海:
更新:第二十八届磁共振脑网络数据处理班(上海,5.22-27)
脑电及红外、眼动:
南京:
北京:
重庆:
上海:
第三届脑电机器学习数据处理班(Matlab版,上海,5.15-20)
数据处理业务介绍:
思影科技弥散加权成像(DWI/dMRI)数据处理
思影数据处理业务三:ASL数据处理
思影科技脑电机器学习数据处理业务
影像组学和影像基因组学工作流程概述
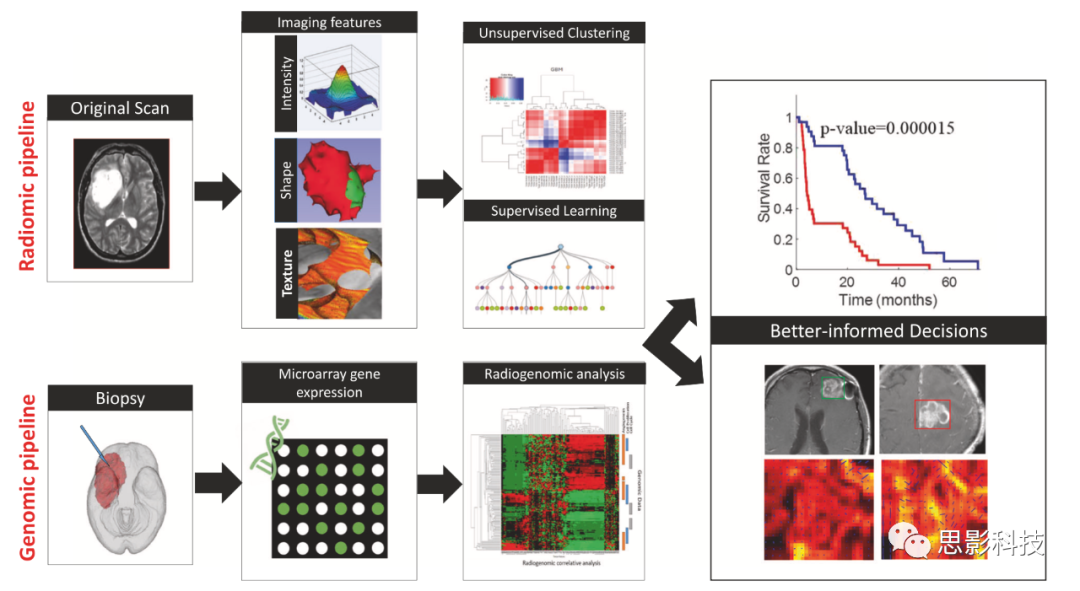 图1,影像组学和影像基因组学流程图
图1,影像组学和影像基因组学流程图
影像组学特征形态学特征
纹理特征结构纹理特征分析
统计纹理特征分析
功能影像组学
语义特征
诊断应用基于纹理特征的不同肿瘤
低级别胶质瘤(LGG)的肿瘤分子亚型特征
区分治疗效果(影像性坏死、假性进展)和肿瘤复发
预后应用胶质母细胞瘤的生存分级
在选择最佳疗法中的应用复发性胶质母细胞瘤的抗血管生成治疗反应分级
讨论
局限性
未来展望
结论
思影科技脑结构磁共振成像数据处理业务(T1)
思影科技脑影像机器学习数据处理业务介绍
思影数据处理服务六:脑磁图(MEG)数据处理
招聘及产品:
思影科技招聘数据处理工程师 (上海,北京,南京)
BIOSEMI脑电系统介绍
目镜式功能磁共振刺激系统介绍