研究目的:利用EEG研究PTSD患者睡眠期间异常的大脑活动,确定其睡眠期间稳定的EEG特征。
方法:78名退伍军人(PTSD组31人,对照组47人)连续2晚收集EEG数据,并对其进行频谱分析。为了评估可重复性,挑选前47个数据(18名PTSD被试)进行探索性分析,剩余的31个数据(13名PTSD被试)进行验证性分析。
结果:在探索性分析中,与对照组相比,PTSD患者有如下表现:
(1)非快速眼动睡眠阶段(NREM),顶叶的delta power降低(1–4 Hz);
(2)快速眼动(REM)和非快速眼动睡眠期间(NREM),前额叶的gamma power升高(30–40 Hz)。验证性分析的结果与探索性分析一致。此外,REM睡眠阶段,两组的theta power(4–8 Hz)不存在差异;NREM睡眠阶段,两组的sigma power(12–15 Hz)不存在差异。
结论:NREM阶段顶叶delta power的降低表明睡眠深度的减弱;REM和NREM阶段前额叶gamma power的升高表明中央脑区的觉醒,这些都是PTSD的睡眠EEG特征。
本研究由美国军队医疗与发展司令部的研究人员sleep杂志。
关键词:PTSD;睡眠;EEG;功率谱
【引言】
睡眠障碍是PTSD的症状之一,如难以入睡、易惊醒、经常做恶梦。已有研究发现PTSD患者的睡眠模式发生了变化。EEG功率谱分析提供了量化的方法来研究与睡眠功能相关的特定频段的神经活动,然而目前只有极少数研究通过频谱分析来判断PTSD患者的睡眠情况。
本研究的目的在于识别PTSD患者睡眠期间的EEG特征,为此连续2晚记录78名退伍军人的EEG信号,其中PTSD患者31名。挑选睡眠有关的脑电活动进行频谱分析,两个晚上的数据均进行分析,以确定组间差异。为了评估研究的可重复性,首先对前47名被试(18名PTSD患者)进行分析,以初步确定PTSD的睡眠EEG特征,然后检验能否在剩下的31名被试(13名PTSD患者)中重复这些结果。
【方法】
被试
招募85名18到50岁的退伍军人,其中PTSD组37人(31男6女)、非PTSD组48人(47男1女)。已有研究发现性别会影响睡眠质量,因此剔除所有女性被试数据以消除性别差异。最终纳入分析的为78名男性退伍军人的数据,PTSD组31人((mean age = 31.3 years, SD = 4.7 years),非PTSD组47人(mean age = 32.8 years, SD = 6.2 years)。所有被试均签署知情同意书。
所有被试至少在实验前两周不服用任何药物影响睡眠。排除存在以下症状的被试:严重抑郁症;精神病或双相情感障碍病史;过去3个月内物质或酒精滥用;严重或不稳定的急性/慢性疾病;外伤性脑损伤的脑震荡后症状或康复治疗;以及除失眠或噩梦外的睡眠障碍。由于饮酒在军人中很常见,因此不排除曾有酗酒史的被试。
睡眠质量的临床评估采用Pittsburgh Sleep Quality Index (PSQI)和Insomnia Severity Index (ISI),PTSD的评估采用Clinician Administered PTSD Scale (CAPS)。通过结构化访谈的形式了解被试目前的睡眠情况。参考DSM-Ⅳ评估被试的情绪、焦虑、精神状态、药物使用等。使用Patient Health Questionnaire-9(PHQ-9)自评抑郁程度。
为了获得被试日常的睡眠模式,要求被试在实验前连续10天完成睡眠日记。
所有被试在实验室待2整天。第一天晚上8点到达实验室,然后佩戴64导电极帽。23点到第二天早上7点休息,整个睡眠期间记录脑电数据。第二天早上移除脑电,让被试完成多组测试,以评估白天的警觉性和认知功能。到了晚上21点,重新佩戴脑电帽记录数据,时间同前一晚。第三天晚上8点,所有被试离开实验室。整个实验持续48小时。
EEG数据记录和预处理
记录64导EEG数据(包含4个EOG)和EMG数据,采样率为250Hz,参考电极为双侧乳突,按照不同睡眠阶段进行分段。利用matlab脚本进行预处理:EEG滤波范围为0.5-50Hz滤波后对数据分段,分段时长为5s。去除肌肉运动、眼动、电极移动等造成的伪迹。非PTSD组,第一夜的数据删除9.2%伪迹,第二夜的数据删除10.4%伪迹;PTSD组第一夜数据删除10.1%,第二夜数据删除10.7%。两组删除的比率差异不显著(p > .220)。
EEG频谱分析
对每个睡眠阶段每个电极分段后的数据进行频谱分析。重点分析与睡眠功能相关的脑电活动:
(1)非快速眼动睡眠阶段的delta活动(1-4Hz),这是睡眠深度的一个指标;
(2)快速眼动睡眠阶段的theta活动(4-8Hz),该指标参与了情绪记忆巩固;
(3)N2阶段的sigma活动(12–15Hz),与学习、记忆巩固有关;
(4)NREM和REM阶段的高频活动如beta-1(15–20 Hz)、beta-2(20–30 Hz)、gamma(30–40 Hz),这是中枢觉醒的指标。最终形成9种组合:NREM delta, REM theta, N2 sigma, NREM beta-1, NREM beta-2,NREM gamma, REM beta-1, REM beta-2, and REM gamma。 统计分析使用Wilcoxon秩和检验来评估各组在临床特征、睡眠日记和睡眠模式等方面的差异。采用同样的统计方法针对所有电极点比较两组的功率谱差异。电极间进行多重比较时,首先卡p值小于0.05的相邻电极团块,然后对筛选出来的电极团块进行10000次置换检验,检验筛选出的电极团块差异是否显著,P小于0.05代表差异显著,最后在差异显著的电极团块里面挑选电极数目最多的团块用来汇报结果。此外,考虑到9个指标的多重比较,使用Bonferroni校正团块检验后的p值。最后,为了统计NREM和REM睡眠阶段的组间差异,研究者以被试组别为组间因素,睡眠阶段为组内因素进行重复测量方差分析。
【结果】
数据集划分
将78名被试划分为2个数据集。前47名被试用于探索性分析,其中PTSD组18人,non-PTSD组29人;剩余的31名被试用于验证性分析,其中PTSD组13人,non-PTSD组18人。
探索性分析
量表得分与睡眠日记
表1展示了临床量表和睡眠日记的量化指标。两组的年龄不存在差异,PTSD组的CAPS、PHQ-9、ISI和PSQI的得分显著高于non-PTSD。根据睡眠笔记的记录进行分析,得到两组的平均卧床时间不存在差异,但是PTSD的平均睡眠潜伏期更长、平均入睡时间更短、平均睡眠效率更低。表1临床表现和睡眠日记(探索性分析)
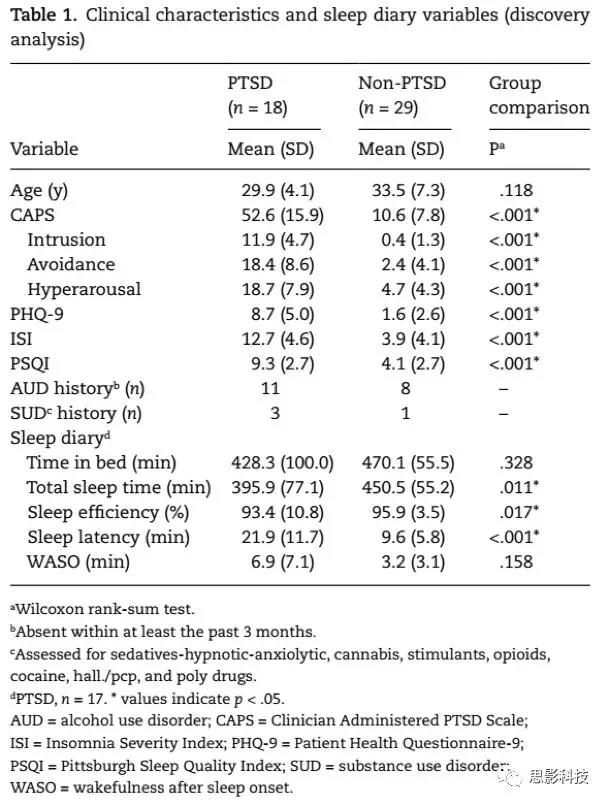
![]()
睡眠模式测量
表2总结了被试在实验室两个晚上的睡眠模式。PTSD组N3睡眠比例显著低于非PTSD组。多项睡眠模式测量指标,包括睡眠潜伏期、总睡眠时间、睡眠效率、起眠时间、每小时觉醒次数和N2睡眠百分比等,在第二夜出现了显著差异(p<0.05),而在第一夜则无显著差异(P>0.05)。
表2 PTSD和non-PTSD量化后的睡眠模式(探索性分析)
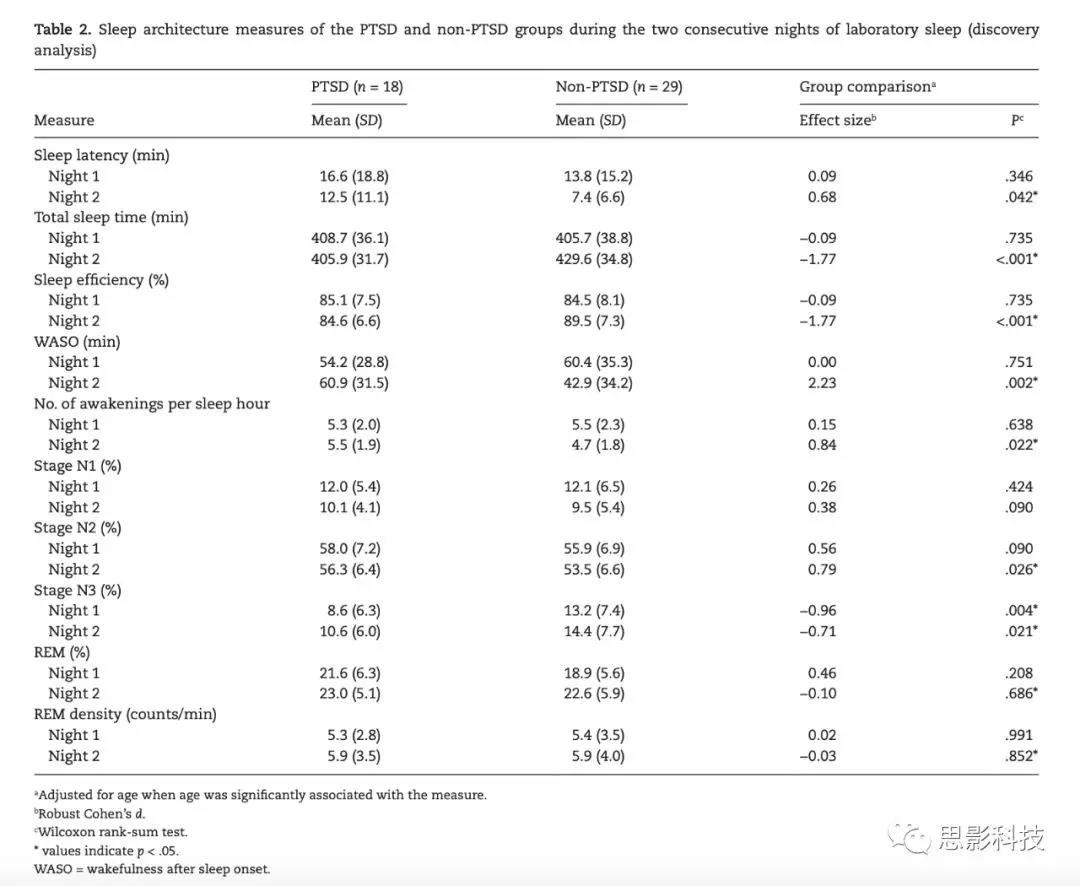
![]()
睡眠EEG power的地形图分析
比较特定睡眠阶段和频段组合下(NREM delta, REM theta, N2 sigma and NREM and REM high-frequency bands,including beta-1, beta-2, and gamma)的两组差异。图1展现了结果,地形图中的黑点代表通过初始统计的电极(未校正的P<0.05),白点表示置换检验后显著的电极团块(p<0.05)。
NREM delta power:两晚的数据均得到PTSD组顶叶的delta power均显著小于non-PTSD。
REM theta and N2 sigma powers:两组差异不显著
NREM and REM high-frequency powers:PTSD组额叶的高频段power(beta-1,beta-2,gamma)均显著高于non-PTSD,这一结果在gamma频段尤其显著。
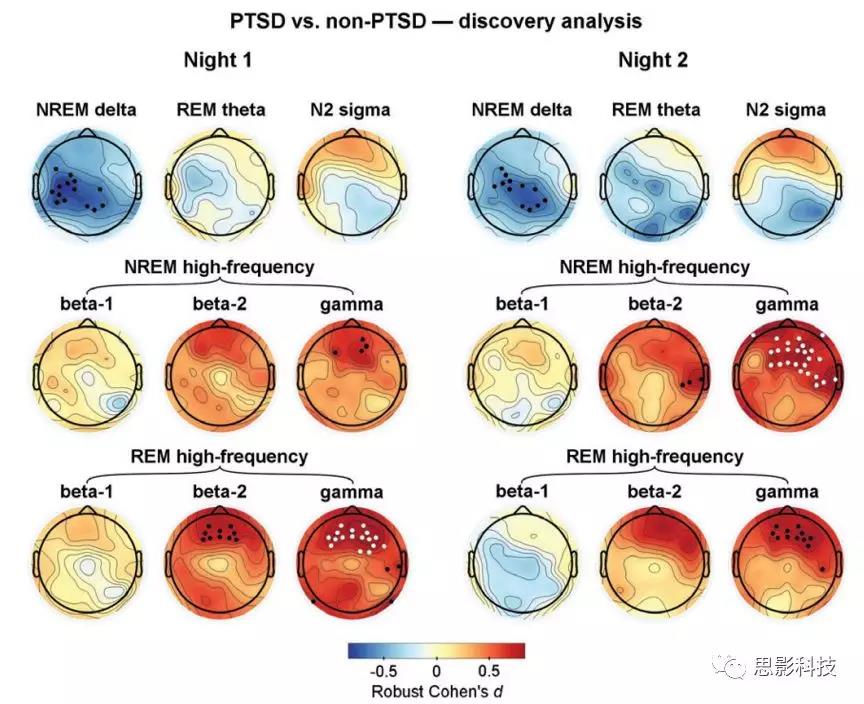
![]()
图1 探索性分析中PTSD组和non-PTSD在各种条件下的差异。地形图中的黑点代表通过初始统计的电极(未校正的P<0.05),白点表示置换检验后显著的电极团块(p<0.05)。
如果您对脑电数据处理感兴趣,欢迎参阅思影科技脑电课程及数据处理服务,可添加微信:siyingyxf详细了解:
第六届脑电数据处理入门班(南京)
第十九届脑电数据处理中级班(南京)
验证性分析
探索性分析得到如下结果:相比于non-PTSD组,PTSD组NREM阶段顶叶的delta power降低,NREM和REM阶段前额叶的gamma power增加。接下来要进行验证性分析去检验这些结果是否具有可重复性。研究者基于图1的地形图选择顶叶作为delta power的ROI,选择前额叶作为gamma power的ROI。图2展示了ROI选取和基于ROI的组差异。表3和图3 汇总了探索性和验证性分析的结果,便于评估有多少结果得到了验证。
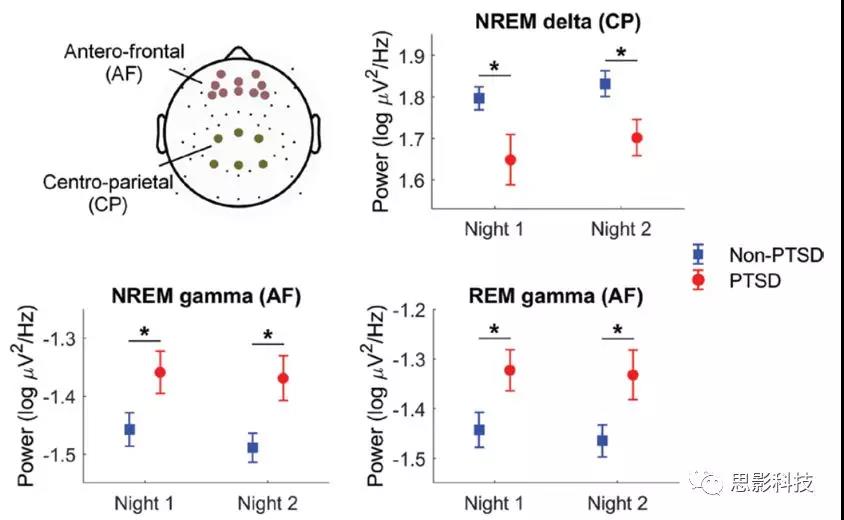
![]()
图2 不同睡眠阶段delta和gamma的组间差异
表3 基于ROI的结果汇总
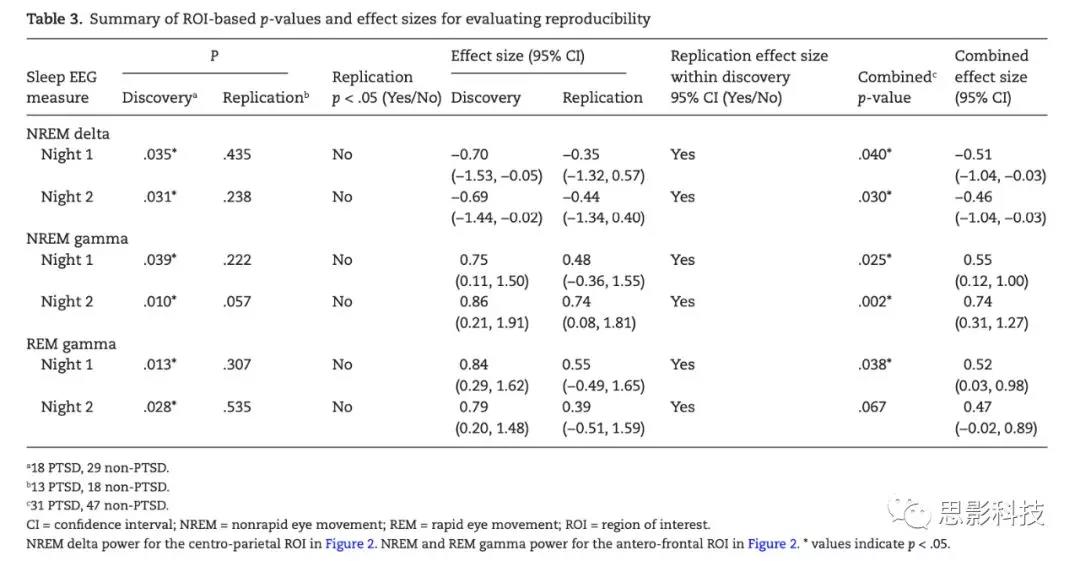
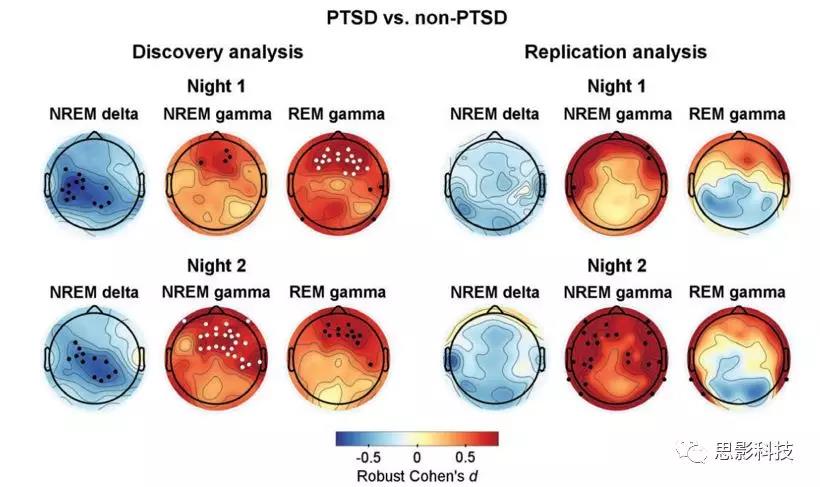
图3 探索性分析和验证性分析的结果汇总。地形图中的黑点代表通过初始统计的电极(未校正的P<0.05),白点表示置换检验后显著的电极团块(p<0.05)
睡眠EEG power与PTSD症状严重程度的相关
计算所有PTSD被试NREM阶段顶叶ROI的delta power、NREM和REM阶段前额ROI的gamma power与CAPS量表总分以及各分量表的相关。图4和表4呈现了结果。第一晚(Spearman’s rho = −0.30, uncorrected p = .097)和第二晚(Spearman’s rho = −0.42, uncorrected p = .019)的数据均显示NREM阶段的delta power与CAPS高唤醒分量表(CAPS-D)存在负相关趋势。
表4 PTSD被试EEGpower与CAPS的相关
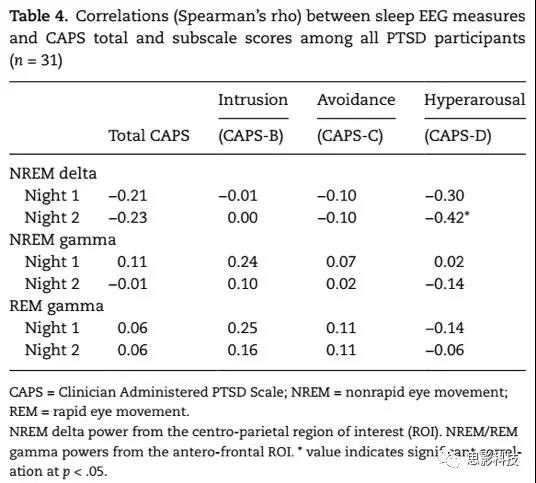
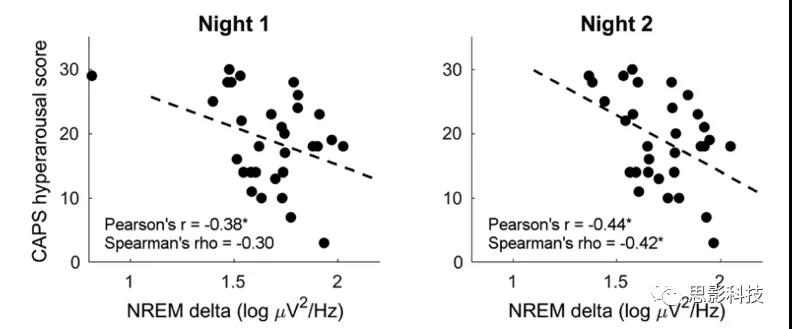
图4 deltapower与量表的相关
整个睡眠周期的delta和gamma power
为了探讨两组被试在不同睡眠阶段的差异,研究者分析所有具有至少3个睡眠周期的被试的delta power和gamma power(31名PTSD被试和46名non-PTSD被试)。图5展示了前3个NREM-REM睡眠周期的delta power(centro-parietal ROI)和gamma power(antero-frontalROI)的时间进程。对NREM阶段的delta power进行2(组别:PTSD vs. non-PTSD)×3(睡眠周期:1 vs. 2 vs. 3)的方差分析,结果发现第一晚的组间差异边缘显著(F1,75 = 3.7, p = .058),第二晚的组间差异显著(F1,75 = 6.6, p = .012),交互作用不显著。Gamma power的结果类似,均发现了显著或边缘显著的组间效应,未发现显著的交互效应。

图5 前3个NREM-REM睡眠周期PTSD组和non-PTSD组delta power和gamma power的时间进程。
【讨论】
PTSD在NREM阶段delta power会降低
这与前人研究结果一致。Delta power是衡量睡眠深度的一个指标,在健康个体中NREM阶段的高delta power往往代表晨间记忆、学习、注意等方面表现优异。PTSD的delta power降低说明相同的睡眠量下PTSD的恢复能力不如健康被试。
PTSD在NREM和REM阶段gamma power会提高
高频的gamma是失眠症研究中中枢觉醒的指标,但在PTSD研究中很少使用这一指标。从目前的研究结果来看,PTSD睡眠过程中的唤醒程度较高,更易惊醒,与其行为症状一致。
睡眠模式存在组间差异
已有关于PTSD睡眠模式的研究存在不一致的结果,有的研究发现PTSD的睡眠模式比对照组差,有的则没有。本研究的结果也出现了不一致的结果,第二夜的结果发现PTSD存在较长的睡眠潜伏期、较低的睡眠效率和较高的唤醒,但是第一夜的结果两组并无差异。两夜结果的不一致可能是由于被试在陌生的实验室环境中会紧张,所以第一夜健康被试的睡眠质量也不佳。
【结论】
本研究的结果表明PTSD睡眠EEG的特点是NREM阶段顶叶的delta power减少,NREM和REM阶段前额叶的gamma power 增加。Delta power降低表明恢复性睡眠不足,gamma power的增加表明中枢觉醒增强。该发现具有临床意义,上述EEG指标可作为PTSD的临床诊断标志。此外,这些指标还可用来评估干预疗效,症状是改善还是恶化等。
如需原文及补充材料请加微信:siyingyxf 或者18983979082获取,如对思影课程感兴趣也可加此微信号咨询。

微信扫码或者长按选择识别关注思影
非常感谢转发支持与推荐
欢迎浏览思影的数据处理课程以及数据处理业务介绍。(请直接点击下文文字即可浏览,欢迎报名与咨询):
第六届脑电数据处理入门班(南京)
第十八届脑电数据处理中级班(南京)
第十九届脑电数据处理中级班(南京)
第九届磁共振脑影像结构班(南京)
第六届任务态fMRI专题班(重庆)
招聘:脑影像数据处理工程师(重庆&南京)