近年来,许多学者已经提出了多种分割方法来自动描绘胎儿和新生儿脑MRI。这些方法旨在定义不同粒度的感兴趣区域:大脑、组织类型或更局部的结构。不同的方法已应用于此分割任务,可分为无监督、参数化、分类、atlas融合(atlas fusion)和可变形(deformable)模型。Brain atlas通常在分割过程中用作训练数据。然而,与图像采集、快速的大脑发育以及较少可用的成像数据相关的问题阻碍了这类分割任务的发展。本文回顾了围产期(怀孕28 周到产后一周)大脑分割采用的方法,并根据目标人群、结构分割和方法类型对它们进行了分类。本文概述了文献中提出的各种方法,并讨论了它们的主要贡献。提出了评估分割精度和分割质量基准的不同方法。本文以围产期大脑分割可能存在的问题和可能的未来发展方向的讨论作为总结。
1. 介绍
围产期大脑的自动形态分析对于定量评估正常的大脑发育和研究认知障碍的神经解剖学相关性至关重要。大脑异常发育与几种神经系统缺陷有关,为治疗干预提供了一个窗口。大约10%的早产儿会发展为脑瘫,多达50%的儿童会发展成认知和/或行为问题。有问题的病例最早可以追溯到胎儿期(fetal age)。脑室扩大是胎儿大脑中最常见的异常,并与精神病、自闭症和癫痫等神经系统疾病有关。
随着磁共振成像(MRI)的进步,胎儿(fetal)和新生儿(neonatal)大脑的详细图像可以无创地在毫米水平显示。使用核磁共振成像的定量神经影像学研究越来越多地用于评估围产期大脑的生长和发育。分割MRI大脑是获得区域大脑结构定量测量的先决条件。大脑的区域体积和形状测量结果是根据大脑的结构分割得出的。覆盖在图像上的分割图对于可视化而言更为重要。扩散加权成像(DWI)和功能MRI(fMRI)可以与结构MRI的分割结果一起使用,以计算与结构连接和功能连接相关的区域测量值。在人群研究中对这些测量值进行系统评估,对于识别大脑中受病理影响的区域以及提供大脑正常发育的信息来说是至关重要的。
体积和皮层表面的定量测量对于描述正常的大脑发育很重要,并且有潜力预测长期的神经发育表现。但是,MR图像的手动分割非常耗时。此外,手动分割会受到观察者之间和观察者内部差异的影响,从而限制了其可重复性。手工方法的这些局限性使得标记人群研究所需的大量被试构成了障碍。因此,需要精确的自动化技术来将大脑分割成感兴趣的结构。新生儿和胎儿大脑的自动分割比成人大脑更具挑战性。围产期脑MRI的对比噪声比(CNR)要低得多,由于脑的体积小,其信噪比常常较低,由于这一时期脑的快速发育,其脑形态和外观也有很大差异。在图像采集过程中,脑MRI进一步受到婴儿运动伪影的影响(胎儿大脑会因为孕妇的自主呼吸、胎儿的自主运动而不可避免的产生运动伪影,而新生儿脑图像的采集需要新生儿处于沉睡情况下进行采集)。
这项研究的目的是对用于胎儿和新生儿脑自动分割的技术进行全面的综述。Devi等人(2015)最近的一篇综述介绍了为新生儿大脑开发的分割技术。在这里,作者将分割技术的综述扩展到了胎儿和新生儿期。此外,作者还提供了这一时期现有脑图谱(brain atlas)资源的总结、基于方法学的技术的详细分类以及未来的发展方向。作者在PubMed上通过搜寻“fetal brain MRI segmentation”和“neonatal brain MRI segmentation” 查找到相关的方法论文。在NeoBrainS12挑战赛(之后会介绍)中使用过的方法也被纳入了本篇综述。本文主要介绍自动化技术,因此需要人介入的半自动化方法不会介绍。这些方法根据目标人群(胎儿、新生儿)、被分割出来的结构(大脑、组织、区域结构)和采用的方法(无监督、参数化、分类、图谱融合(atlas fusion)、可变形(deformable)模型)进行分类。
本文的组织如下。在第2节中讨论了发育中大脑的自动分割所面临的挑战。第3节中介绍了通常作为分割的先验信息提供的图谱。第4和第5节简要总结了在分割之前需要使用的图像采集和预处理技术。第6节介绍了在本综述中不同类别的分割方法。第7节和第8节介绍了胎儿和新生儿文献中提出的不同的分割方法。对分割技术的评价介绍在第9节。最后,总结并讨论了该领域未来可能的发展方向。
2. 挑战
尽管在获取磁共振图像方面取得了一些进展,但自动化的大脑分割仍然是一项艰巨的任务。在MR图像中有一些重要的挑战,这些挑战阻碍了分割,而与当前的应用无关。不同组织类别的强度不是均匀的,而是在图像空间上逐渐变化的。这种强度非均匀性(INU)是由非单形射频(RF)场和接收灵敏度以及与身体的电磁相互作用造成的。更高场强的扫描仪会导致更大的强度变化。图1展示了INU效应。在单个体素中混合不同组织类别的部分容积(PV)效应给组织边界的精确描绘带来了额外的困难。由于图像分辨率有限,包含多个组织的体素产生的强度表示体素中多种组织的混合强度。图像噪声经常是比较明显的,可能是由于人体中的电磁噪声和接收电子设备中的小异常造成的。胎儿和新生儿脑MRI的自动分割比成人脑分割具有更大的挑战性。围产期脑MR图像进一步显示了该领域特有的挑战:
a) 与成年人相比,婴儿脑MRI运动伪影的发生率更高。胎儿和未镇静的新生儿表现出明显的运动,这就需要采用更快的采集技术或多次采集大脑影像来校正运动。运动伪像表现为未对齐的图像切片和沿相位编码方向的重影(ghosting effects)现象(如图2所示)。
b) 由于胎儿/新生儿的大脑体积小,扫描时间短,所以对比度较低(CNR)。
c) CSF-WM 部分容积(PV)效应。胎儿/新生儿MR图像与成人图像相比,表现为反转的WM(白质)/GM(灰质)强度对比。WM在围产期脑内无髓鞘,在T2加权像上比GM更亮,而在成人图像上GM比WM具有更大的强度值。CSF和GM在CSF-CGM(CG即cortical GM)边界上的混合导致了其与WM相似的强度(见图3)。这种PV效应导致了CSF-CGM界面将PV(部分容积)体素错误地标记为WM。
d) 由于在此期间大脑的快速发育,围产期大脑的形状和结构外观差异很大。皮质带迅速折叠并形成深的灰质结构。此外,WM髓鞘形成在大脑发育过程中是一个持续的过程,在不同的WM区域逐渐明显。由于不同扫描年龄的受试者在解剖学特征上存在这些差异,因此对其进行精确的定位具有挑战性。图4展示了在新生儿大脑中随着扫描年龄的增加所发生的变化。
e) 缺乏跨越不同扫描年龄的手工标记图谱。人工描绘精细的解剖结构需要专业的解剖学知识,而且非常耗时。与成人大脑图谱(atlas)资源不同,围产期脑图谱数据资源非常有限。大脑形态的巨大变异性加上缺乏大脑图谱资源对分割技术提出了挑战,因为训练数据是稀缺的。
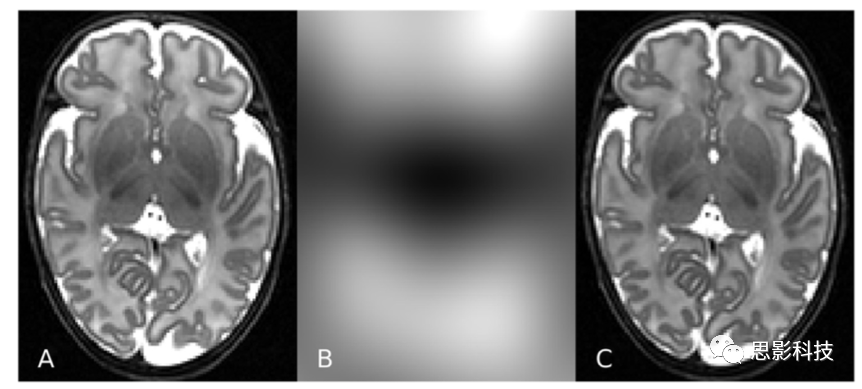
图1.新生儿T2 MR图像上显示的MRI强度不均匀性(A)。图像(B)和(C)使用N4偏置场校正分别呈现估计的偏置场和偏置校正后的图像。

图2所示。胎儿(1)和新生儿(2)T2 MR图像上的运动伪影。在相位编码方向切片的模糊和重影效应(1.A,2.A)以及切片沿方向的错位(1.B,2.B)表明了明显的运动。
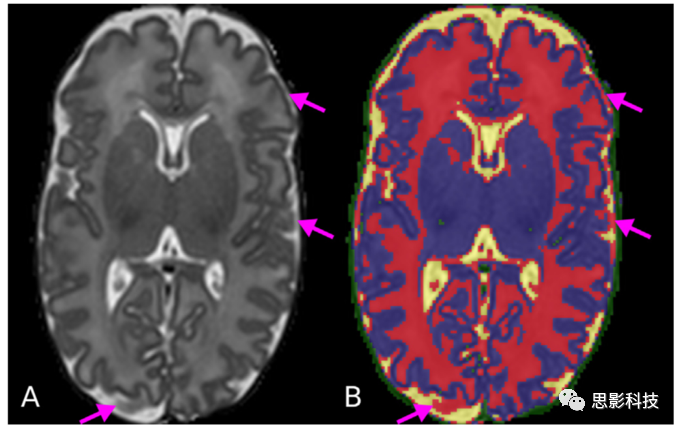
图3所示。CSF-WM 部分容积效应明显存在于CSF-CGM边界。新生儿T2 MR图像(A)分为不同的组织类型(黄色:CSF,红色:WM,蓝色:GM,绿色:背景) (B)箭头所指的区域是CSF和CGM的部分容积,使得其强度与WM的强度相似。
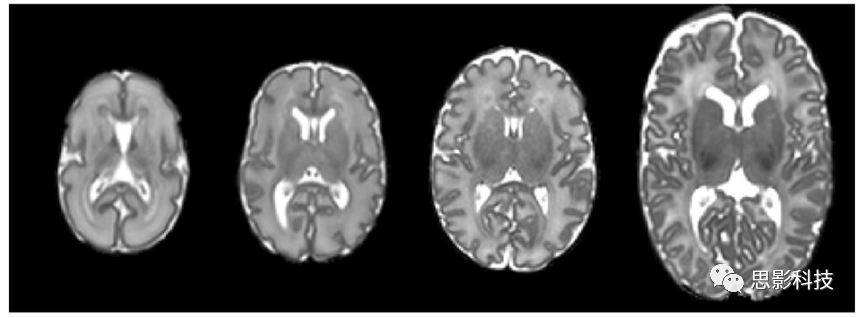
图4所示。分别在PMA 28周、32周、36周和44周时获得新生儿大脑T2 MR图像(从左至右)。
2. 图谱(Atlases)
脑图谱(atlas)是经过标记的数据,它表明了大脑不同结构的位置,通常用作自动分割算法的范例。术语atlas经常以一种含糊不清的方式使用。在这篇综述中,将使用术语atlas来指代一对图像:一个是脑模板(atlas template)图像(例如大脑的MR图像),另一个是图谱分割标签(atlas label)图像。图谱标签图像表明每个体素处的解剖结构或组织。有两种类型的脑图谱:一种是在每个体素上指定单个结构/组织标签的个体图谱(single-subject atlas),另一种是定义了每个体素上每个结构/组织的结构概率的概率图谱(probabilistic atlas)。个体图谱通常是手工绘制的,而概率图谱通常是通过将一批通过自动化程序得到的分割图像进行平均得到的。
图谱标签可以通过将图谱(源)的MR图像配准到待分割的被试(目标)的MR图像上从而可以得到待分割的被试的分割图像。配准过程估计了图像之间的转换和映射,从而最大化了源图像和目标图像之间的相似性。配准可以是全局的,也可以是局部的,分别估计源到目标图像的线性(刚性或仿射运动)或非线性变换(局部运动)。然后可以将估计出来的变换将图谱图像和图谱标签变换到个体(被试)空间中。早期的基于图谱的分割方法就是通过将单个标记好的图谱标签变换到目标图像空间完成分割的。但是,如果只使用单个图谱,那么分割仅限于一对大脑之间的精确配准,由于被试的解剖结构差异很大,因此这不是一个简单的问题。所以引入概率图谱来解决此类问题。概率图谱是通过对大量被试的脑图像和相应的分割图像求平均而构建的。将个体图像配准到平均模板通常比向另一个个体图像配准所出现的挑战要少,因为平均图谱已消除了很大的解剖差异。 另外,概率图谱在每个体素上提供了每个结构的概率估计。这对于要求每个标签都具有先验概率模型的概率分割方法至关重要。解决单个图谱配准不准确的另一种方法是使用多个图谱,其中将不同的图谱独立地与被试数据进行配准。这样可以使用多个图谱对单个图谱所引入的误差进行平均,并提高结果的准确性。通常,会使用多个单个被试图谱或概率图谱用于分割,以适应个体大脑的解剖变异性。基于single-atlas的分割框架基本上可以用下图来表示:
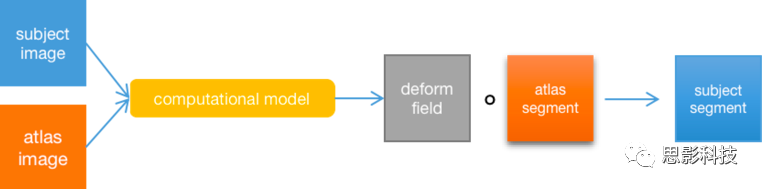
基于single-atlas的分割框架。首先个体图像和图谱图像输入到一个广义的计算模型中,计算从图谱空间变换到个体空间的形变场,然后再将计算得到的形变场应用到图谱分割上,将图谱分割从图谱空间变换到个体空间得到个体分割图像(注意,这只是个简化模型,现在的基于图谱的分割算法多是基于multi-atlas的)。
以下各节介绍了新生儿和胎儿领域中存在的个体(single subject)图谱和概率图谱。表1总结了不同的图谱。表3进一步列出了围产期大脑的公开图谱。表1 与胎儿和新生儿脑图谱构建相关的研究
3.1. 个体图谱(single-subject atlases)
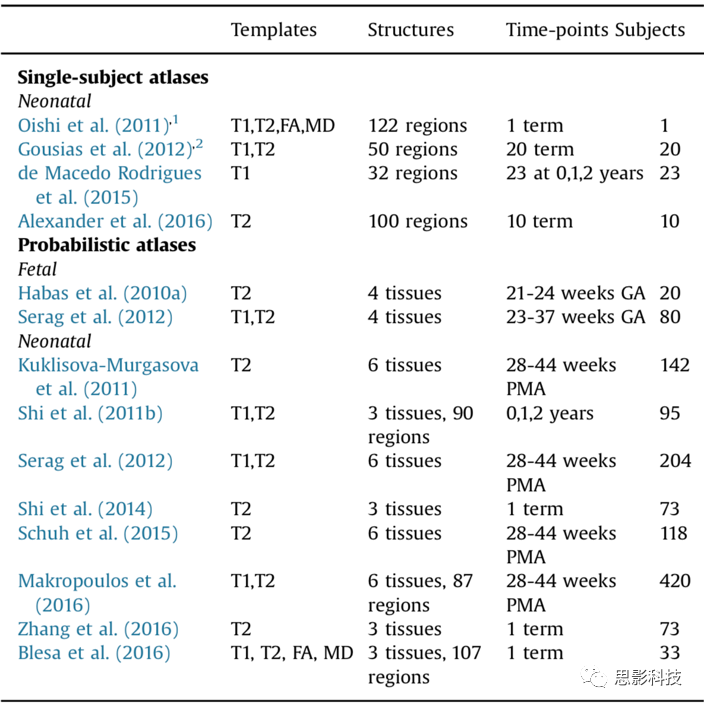
现有文献中为围产期大脑构建的个体图谱有限。Oishi等人(2011)构建了一个由T1、T2和DTI组成的多模态新生儿脑图谱,并在单个被试脑图像上手工划分了122个区域。手工划分是基于DTI数据上观察到的白质束和回旋模式。相反,Gousias等人根据T1和T2数据生成了多个个体图谱。他们在大约足月年龄的不同扫描时间的20名新生儿上手工描绘了50个结构(Gousias等人(2012)的一个图谱如图5所示)。de Macedo Rodrigues等人(2015)使用T1图像构建了不同年龄的多个个体图谱。将23例扫描年龄在0至2岁之间的婴儿(包括4名新生儿)的脑部MR图像手动分割为32个区域。Alexander等人(2016年)建立了最新的脑图谱,在10例足月新生儿的T2图像中描绘了100个区域。该图谱的一个重要特征是它复制了Desikan-Killiany方案,该方案在成人研究中广泛使用并用于新生儿大脑(见图6)。
图5 由Gousias等人(2012)手动描绘的图谱将大脑分为50个区域。
3.1. 概率图谱
目前已经为新生儿大脑建立了几套概率图谱。Kuklisova-Murgasova等人(2011年)使用非参数核回归方法构建了扫描年龄在28-44周之间的第一个新生儿大脑时空图谱(时空图谱即在不同年龄的时期上构建了三维脑图谱,借此可研究纵向的影像数据)。他们基于142个仿射配准到公共空间的图像计算了平均T1和T2模板。每一个年龄段的图谱进一步伴随着从被试脑图像的组织自动分割中估计出的组织概率图。Serag等人(2012)使用类似的方法开发了具有时空模板和组织概率图的“高清”脑图谱。Schuh等人(2015)遵循了相同的原则,但是使用了不同的配准方法(源数据和目标数据之间的对称配准以产生反向一致的空间变换),使用118例新生儿扫描数据创建了年龄段位于28到44周的脑图谱。Makropoulos等人(2016)利用时空概率图和标签图进一步改进了Serag等人(2012)的脑图谱,利用420幅自动分割的新生儿MR图像对87个结构进行了估计。Shi等人(2011b)基于三个年龄层扫描的95名受试者,提出了第一个包含三个婴儿大脑时间点的纵向脑图谱: 新生儿、1岁和2岁。采用纵向组织分割、基于自动解剖标记(AAL)图谱(Tzourio-Mazoyer et al.,2002)和groupwise配准计算三个模板(新生儿为T2, 1岁和2岁为T1)、组织概率图和90个结构的分割标签图。最近,Shi等人(2014)使用基于稀疏patch的技术构建了一个由T2模板和组织概率图构建的图谱。他们使用了73名新生儿的MR图像,并按照Wang等人(2011)提出的方法进行group-wise配准,自动分割成不同的组织类型。Zhang等(2016)也采用了基于patch的方法,将小波分解后的大脑图像分割成不同的频带。其T2模板和组织概率图与Shi等人(2014)使用相同数量的被试数据得到。Blesa等人(2016)制作了一个单一时间点的多模态脑图谱,他们使用了T1、T2、FA、MD模板和33名被试的MR图像。基于自动分割的组织概率图,根据AAL图谱中标签的传播,构建了具有107个标签的标签图像。
Habas等(2010a)构建了第一个胎儿大脑时空图谱。他们在被试之间使group-wise配准,并用多项式来建模磁共振强度、组织概率和胎儿大脑形状的变化。他们的图谱使用了20个胎儿大脑的T2图像和手工分割标签。 Serag等人(2012)在新生儿脑图谱的基础上,使用80个胎儿脑图像数据,得到了处于23 ~ 37周胎儿大脑和组织概率图的时空图谱。

图6所示。Serag等人(2012)构建的新生儿大脑时空概率图谱。
4. 图像采集
围产期大脑的MR成像需要不同于成人大脑的采集协议。未成熟的围产期大脑含水量比成熟的高,需要不同的扫描参数。另外,由于患者运动,需要更快的扫描序列,例如快速自旋回波技术,以获得具有较少的运动伪影的图像。这是由于胎儿运动和产妇呼吸,运动在胎儿脑MRI中尤为明显。胎儿脑MRI通常是通过非常快速地获取2D切片来获取的,从而“冻结”切片中的运动。但是,二维切片通常彼此不对齐,因此妨碍了自动大脑分割。三维重建技术通常用于校正此类问题。Slice-to-volume(SVR)技术通常在两个迭代步骤中执行此校正:
a)从2D切片进行3D重建,以及b)将2D切片重新对齐到3D volume。一个替代的重建技术通过优化所有切片对的交点来对齐切片。文献中已经提出了许多运动校正技术来纠正运动,要么在图像采集过程中进行校正,要么在k空间中进行重建。
5. 图像预处理
在分割之前,通常会采用不同的预处理步骤。最常见的是强度校正和颅骨剥离。强度不均匀性(INU)校正旨在消除在整个图像上显示为平滑变化信号的强度偏差。INU校正可以在分割之前和/或在分割过程中执行。N3和N4算法通常用于围产期大脑中的INU校正。文献中还进一步采用了诸如各向异性扩散之类的滤波技术,以在保留边缘的同时减少图像中的噪声。组织和结构分割方法在处理之前通常先进行脑提取。在本文中,作者将脑提取技术描述为一种特殊的分割方法,并在第7.1节和第8.1节中对胎儿和新生儿的脑提取技术进行回顾。
6. 不同类型的分割方法
这篇综述的分割技术分类如下:
a) 将目标人群分为胎儿或新生儿。
b) 被分割成脑、组织或结构的分割方法。
c) 采用不同类型的分割方法:无监督、参数化、分类、地图集融合、可变形模型。 以下各节详细介绍了方法类别。因此,第7节和第8节分别详细介绍了胎儿和新生儿文献中针对不同类别提出的分割技术。表2展示了此综述中针对其类别讨论的不同细分方法。表3列出了本综述中讨论的公开可用方法。
6.1. 无监督技术
无监督技术根据脑图像内固有的相似性对数据进行分类,所以不需要训练数据。无监督技术通过挖掘基于图像的特征,把脑图像分割成强度不同的区域。在医学图像分割中使用的方法通常是从标准图像处理中采用的:阈值化,区域增长,形态运算,分水岭分割,边缘检测和聚类技术。无监督技术本身很容易受到噪声、强度不均匀性和部分容积效应的影响,因此很难适应不同的扫描序列和具有较大的解剖学差异的脑图像数据。在围产期脑分割文献中,这些方法主要用于其他方法的预处理和后处理目的,例如:参数化技术。聚类技术已被用来计算特定对象的组织先验来初始化参数技术。已使用区域生长、形态学操作和分水岭分割来识别/分离图像中的连接区域,并根据重叠的组织强度分布(例如WM与CSF或CGM与背景之间的强度)校正部分体素。然而,结合无监督技术也成功地用于大脑和组织的分割。
6.2.图谱融合(atlas fusion)技术
图谱融合方法是基于已对齐图谱的标签对图像进行分割的方法。标签融合技术通过投票法来融合来自不同图谱的标签。研究人员提出了多种投票方案,可以根据图谱MR图像与待分割图像之间的相似性(无论是全局的还是局部的),对每个图谱的贡献进行加权平均。基于patch(所谓patch即将3D的脑图像切成一个一个的2D图像块或者3D图像cube)的技术为标签融合技术提供了一种非局部的替代方法。在基于patch的方法中,图谱中最相似的patch位于图像的每个patch的中心体素附近。图像patch中心体素的标签是是由一系列权重融合得到的,这些权重是由围绕这些中心体素的图谱patch与中心体素的patch之间的相似性定义的。这些权重可以减少由多个不同图谱所导致的联合误差。Warfield等人(2004)提出了另一类图谱融合技术STAPLE(Simultaneous Truth and Performance Level Estimation)。STAPLE计算真实分割的估计,并根据每个图谱在分割上的性能对图谱进行加权。重复该过程,直到算法在EM框架中收敛为止。在围产期文献中,使用图谱融合的技术进行分割是相对有限的。这是由于大脑在不同年龄的扫描时间会发生较大的发育变化,并且不同年龄的图谱分割标签数量有限。在被试年龄不同的图谱之间进行配准是一个较为困难的任务,例如将足月孩子的大脑配准到早产儿的大脑上。但是,通常使用图谱融合技术来得出不同结构的初始概率估计值,然后通过诸如参数化或可变形技术之类的自适应技术对其进行完善。
6.3. 参数化技术
参数化模型通过对数据进行拟合来解决分割问题。(后验)体素概率由空间先验项和强度项组成。空间先验分布本质上是对每个结构的空间位置进行编码,通常基于图谱数据。强度模型参数分布的典型选择是高斯混合模型(GMM),其中每个大脑结构的强度似然采用高斯分布建模。然后,使用期望最大化算法(EM)、迭代条件模式法(ICM)或图割法(graph-cut method, 在前深度学习时代,图割法是图像分割领域很常用的一种方法。它通过把图像转化为由多个超像素构建的图像,每个超像素包含多个空间邻近且强度相似的像素,每个超像素作为一个结点,超像素之间的相似关系构建为边,这样可以把一张图像建模成图模型)来将模型拟合到数据中。参数模型的一般扩展包括: MRF正则化来建模结构的空间相互作用,偏场校正来解释强度的不均匀性,以及先前的松弛来缓解错误配准和病理的影响。由于其准确性和对解剖结构差异的鲁棒性,该系列模型已被大多数新生儿和胎儿分割方法采用。强度建模允许根据图像的强度信息来适配,通常从概率图谱或图谱融合中得出空间先验信息。图割法已用于脑分割,而EM用于脑、组织和结构分割。
6.4. 分类技术
在图谱上直接训练分类器,以基于图像衍生的特征(例如,单模态或多模态的强度和空间特征)来学习分割标签。由其他分割技术计算得到的估计标签可以进一步合并为特征,以进一步纠正分类技术导致的细分偏差。然后,分类器基于学习的模型在对象图像中标记体素。分类技术,尤其是卷积神经网络,由于其在计算机视觉任务中的出色准确性以及对不同领域的模型的适应性,成为近年来最受欢迎的分割方法之一。围产期文献中的示例分类技术采用了k-NN、朴素贝叶斯(Bayes)、决策森林、SVM分类器和最近的卷积神经网络。(换句话来说,基于分类技术的分割算法,实际上就是提取每个体素的特征,可以是强度特征、图像纹理特征或者上下文特征,把这些特征放入分类器中训练,让分类器可以为每个体素进行分类)
6.5. 可变形模型
可变形模型是基于物理的模型,它通过对一个封闭的表面进行变形来分割一个物体。这个表面在内外能的影响下不断地膨胀或收缩(编者注:可以理解为气球模型,只不过气球需要从卷曲的表面映射回光滑的球状面,而可变形模型相当于气球模型的反转,从光滑的球表面通过内外力的作用下,收缩到卷曲的表面,收缩的过程是由外力驱动,而卷曲表面边界的稳定则是由内力维持)。外部能量通常是一个图像驱动的数据拟合项,它将表面移动到所需的对象边界。内能保证了传播面的平稳性,约束了由外能驱动的演化。内能可以进一步包含有关目标物的先验知识。可变形模型分为两类:参数模型和几何模型。参数模型提供了曲面的显式参数化。一个使用参数可变形模型的示例方法是广泛使用的大脑提取算法BET,由Smith(2002)提出(作为FSL软件的一部分实现)。几何模型,又称水平集可变形模型,将曲面隐式表示为高维函数的零水平集。几何模型被用来约束皮层外表面(CSF-GM边界)和皮层内表面(GM-WM边界)之间的距离。可变形模型通常用于单个结构的分割,其中形状的先验知识对于分割非常重要,例如大脑的分割(特定形状)或皮层带的分割(特定厚度)。
表2 本文中按类别讨论的细分方法

表3 可公开获得的用于脑部MRI分割的图谱和软件

7. 胎儿期分割
在本节中,将会介绍以往的研究文献中所提出的胎儿期大脑分割算法。第7.1节介绍了大脑提取方法,第7.2节介绍了对不同组织类型的分割方法。
7.1.大脑分割(提取)
大脑提取是指从磁共振图像中去除头皮和头骨,只留下脑脊液和脑组织。胎儿大脑的分割是一项具有挑战性的任务,因为胎儿的大脑需要与母体进一步分离。此外,胎儿大脑的运动也会使这一分割任务明显复杂化。
a) 参数化技术
Anquez等人(2009年)采用了三阶段的颅骨分割过程。他们首先通过模板匹配和对比度、形态和生物特征识别先验信息来检测胎儿的眼睛。之后,他们将大脑在矢状平面内分割。最终将形状配准到这个volume上并用于分割3D大脑。使用图割法进行分割。如果在较宽年龄范围内对胎儿大脑使用该方法进行分割,则单一形状的配准可能会出现问题,并且具有运动伪影的图像中容易出现错误。
b) 分类技术
Ison等人(2012)使用随机森林分类器来抑制母体组织的影响并基于3D Haar特征识别大脑的可能位置。因此,使用高阶MRF对大脑进行了分割。Keraudren等人(2014)开发了用于从具有运动伪影的3D volume中进行大脑检测的方法。最初检测到最大稳定极值区域(MSER),即内部强度均匀,边界强度高的区域。然后针对这些区域计算尺度不变特征变换(SIFT)特征,使用k-means算法进行聚类,然后使用支持向量机(SVM)分类器将其分类为大脑/非大脑。然后,通过将随机森林分类器应用于2D切片的patch上并使用条件随机场(CRF)来细化初始分割。Kainz等人(2014年)采用了类似的方法,但是在3D Gabor特征上训练了随机森林分类器。因此,使用2D水平集对分割进行了细化。 该方法已针对GPU实现,并且仅需7s即可进行大脑分割。Rajchl等人(2016)最近提出了一种基于3D卷积神经网络和CRF的方法。迭代计算CNN和CRF,直到收敛为止。他们的方法是通过在一组使用边框框住大脑的数据上进行训练来执行脑分割的,而不是在一堆经过手工分割的大脑数据上。
c) 图谱融合技术
Wright等人(2014)利用Eskildsen等人提出的(2012)基于patch的大脑分割技术从胎儿MR图像中提取大脑。Eskildsen 等人(2012)的方法是一种多分辨率的基于patch 的Coupéet 等人(2011)提出的技术的拓展版本,这个技术原来用于从成人MRI图像中提取大脑。Tourbier等人(2015)也使用了多图谱分割。他们采用了基于归一化相关系数(NCC)的全局权重对多个图谱融合。图谱融合技术对于配准错误十分敏感,而配准错误经常发生在具有运动伪影的胎儿图像上。为了缓解这个问题,Wright等人(2014)、Tourbier等人(2015)在执行大脑提取任务之前使用了SVR技术。
7.2.组织分割
一些技术也提出了对胎儿大脑进行组织分割。胎儿大脑的组织分割已经在用SVR重建或没有明显运动的胎儿图像上进行了。
a) 参数化技术
Habas等(2008,2010b)最早提出了一种胎儿脑组织分割的方法。他们采用了与Van Leemput等人(1999)类似的带有偏差校正的EM模型,并进一步引入了MRF惩罚项,以确保对附近的体素进行类似的标记。在他们后期的工作中,Habas等人(2009)将atlas先验与层间先验相结合,对模型进行了扩展,层流先验是基于深度的先验,使用拉普拉斯方程进行估计(Jones等人,2000)。Cuadra等人(2009)提出了一种无atlas组织分割的EM方案。他们将两种高斯函数混合用于CGM和WM,而不是单一的类。用经验值初始化GMM的高斯参数。但是对于在不同年龄的胎儿分割任务上这种方法可能会出现一些问题,这是因为在不同年龄下大脑的发育和髓鞘形成存在差异。他们进一步提出了基于体素邻域的具有局部成分的MRF和基于皮层厚度图谱的具有全局成分的MRF。PV校正使用基于知识的规则执行。对四名受试者进行了有限的评估。Wright等人(2014)同样使用Ledig等人(2012)开发的EM-MRF分割方法对新生儿图像(下一节将介绍)进行分割,以便从胎儿MRI中分割组织。
b) 可变形模型
Dittrich等人(2011)提出了一种基于水平集的组水平分割技术,这个算法从数据中推断出一个潜在的图谱,这反过来又约束了个体的分割。他们用一个包含图像似然项、空间先验项和平滑约束的水平集的概率公式对分割进行建模。每一项的参数以交错方式最小化。图像似然项的参数用一个GMM建模,然后用EM算法对每个图像进行优化。空间项参数估计为所有个体分割的年龄加权概率平均值,可以认为是一个“时空隐图谱(spatio-temporal latent atlas)”。所有的图像在分割前用组配准技术对齐。分割是针对单个结构执行的,并且基于单个手工分割的图谱。Gholipour等(2012)提出了一种基于形状的分割技术,用于胎儿MRI中脑室的分割。通过使用STAPLE (Warfield et al., 2004)得到初始分割。然后通过结合强度和局部空间信息的概率形状分割得到分割结果。引入惩罚项来考虑不同形状的交点和区域的平滑度。
8. 新生儿期分割
分割方法在新生儿大脑中的应用越来越广泛。第8.1节介绍了用于大脑分割(脑提取,也叫颅骨剥离)的方法,第8.2节介绍了用于组织分割的方法,第8.3节介绍了用于更细致的结构分割的方法。
8.1. 脑提取
用于成人大脑的大脑提取技术,如BET (Smith, 2002)和BSE (Shattuck et al., 2001),通常会用于新生儿大脑,并已在相关论文中使用。然而,也已经开发了提取新生儿大脑的算法,并在以下介绍。大多数已开发的技术将其准确性与BET和BSE进行比较。
a) 无监督分类技术
Peporte 等人(2011)开发了一个atlas-free分割方法,这个方法基于形态学操作的组合、区域增长和边缘检测以提取大脑区域。通过在每个2D切片上分别使用k-means聚类得到的阈值来执行自适应阈值。然而,在Peporte等人(2011)的工作中,只是用了5个被试的数据用于评估验证。
b) 参数化技术
Mahapatra(2012)提出了一种基于图割法的颅骨剥离方法。他们合并了来自概率mask的先验信息,并引入了利用梯度信息的平滑项。Serag等人(2016)将他们的方法与其他11种大脑分割技术进行了比较,包括BET和BSE。
c) 分类技术 Serag等人(2016)提出了一种将MRI分为大脑和非大脑区域的方法,该方法使用朴素贝叶斯或线性判别分析分类器。选择那些可在整个图谱数据库中提供补充信息的图谱。
d) 可变形模型
Yamaguchi等人(2010)提出了一种基于主动表面模型的颅骨剥离方法。使用贝叶斯分类方案下的高斯混合模型对强度信息进行建模。从构造的图谱的组织概率图中合并先验信息。Yamaguchi等人(2010)没有对他们的方法进行定量验证,而是依赖于对结果的视觉检验。类似地,Kobashi和Udupa(2013)提出了一种基于模糊对象模型的技术,这是一种使用先验形状模型的主动表面模型。Kobashi和Udupa(2013)对10个实验对象的结果进行了定量评估,但是没有将他们的方法与其他的大脑提取技术进行比较。Yamaguchi等人(2010)和Kobashi和Udupa(2013)进一步将脑脊液从脑组织中分离出来。Shi等人(2012)开发了一种结合BET和BSE两种脑提取技术的元算法。对这两种技术的参数进行优化,然后用于被试的分割。采用基于水平集的分割算法对不同参数的脑提取进行融合和细化。为了降低计算复杂度,Shi等人(2012年)使用亲和力传播技术基于图谱的强度相似度选择图谱。 他们对246名被试数据(包括75名新生儿数据)进行了广泛的数据库验证,并将他们的技术与其他六种方法(包括BET,BSE和STAPLE)进行了比较。
8.2. 组织分割
在新生儿分割领域的研究主要集中于脑MR图像的组织分割。本节介绍文献中用于新生儿组织分割的方法。图7给出了不同组织类型的分割示例。
a) 无监督分类技术
Gui等(2012a,b)提出了一种基于脑形态学先验知识的无atlas 分割方法。在他们的工作中,Gui等(2012b)使用T1和T2两种模态数据,并应用分水岭分割、区域生长、主动轮廓分割和形态学操作对脑组织进行分割。由于Gui等人(2012b)不依赖图谱,他们的方法不受图谱配准错误的影响。
b) 参数化技术
Prastawa等人(2005)基于Van Leemput等人(1999)的EM算法开发了一种组织分割方法。这项工作的新颖之处包括根据基于图的聚类技术(最小生成树)区分有髓鞘和无髓鞘的WM类,并使用最小协方差行列式(MCD)估计去除异常值。使用MCD估计器估计高图谱概率的样本位置的初始强度估计。利用非参数核密度估计进一步细化分割结果。该技术的一个缺点是通过对三个被试的半自动分割结果平均来创建图谱,因此很难捕获新生儿人群中存在的巨大脑解剖差异。 Xue等人(2007年)类似地实现了带有MRF正则项的EM方案。但是,Xue等人(2007年)放弃了使用图谱作为脑组织先验信息,而是依靠k均值聚类来获得特定于被试的组织先验。在处理之前,根据手动分割的图谱去除深层灰质组织。Xue等人(2007年)使用一种基于知识的方法对CSF-WM部分容积效应(partial volume effect)问题进行了解决,该方法使用连通分量label来实现。作者还介绍了大脑在不同区域的局部分裂,并以局部方式估算了高斯参数。Cardoso等人(2011,2011,2013)提出了另一种解决图谱配准错误的方法,提出了一种类似于Shiee等人(2011)的适用于图谱先验的EM-MRF方案。由图谱提供的图谱先验模型建模为从Dirichlet分布中抽取的样本,并根据每次EM迭代的后验进行了调整。将CSF-WM 部分容积效应建模为不同组织之间的混合分布。此外,他们通过在组织上引入半共轭高斯先验而偏离了经典的高斯模型,该方法是通过手动选择的代表不同组织的patch初始化的高斯方法。Melbourne等人(2012年)扩展了Cardoso等人(2011年,2013年)的工作,以进一步对与估计模型具有较大马氏距离的强度聚类进行离群值剔除,以减少其在参数估计中的影响。 Makropoulos等人(2012b)提出了一种具有图谱适应性的分割方法,类似于Cardoso等人(2011,2013)的工作。 如Xue等人(2007)所述,对CSF-WM强度重叠进行部分容积校正。添加了第二个部分容积校正步骤以校正WM-GM边界,从而可以更细致地描绘皮质带。结构先验是由Atlas先验和特定于被试的先验的组合而获得的,这些先验是通过用k均值进行强度聚类得到的,以提供对先验更好的初始估计。 Ledig等人(2012)通过引入二阶MRF和Cardoso等人(2011)的MRF模型,扩展了Cardoso等人(2011,2013)的EM-MRF模型。如果在该类的邻域中存在一对类,则二阶MRF会对该类的存在进行惩罚。Shi等人(2010年)提出了一种利用特定于被试的概率图谱进行新生儿组织分割的框架,该图谱是根据以后获取的纵向数据生成的。该图谱是使用AFCM(一种模糊聚类技术)构建的。之后,将图谱用于联合配准分割框架中,该框架在改进的EM算法中迭代执行图谱配准、偏置场校正和基于图谱的组织分割。在他们后来的工作中(Shi等人,2011a),根据Shi等人(2010)计算的新生儿大脑分割,根据其与被试的相似性,构建了特定于被试的图谱。使用Hessian滤波器在被试的皮质GM置信度图上测量相似度。像Shi等人(2010)一样,使用构建的特定被试的图谱以联合配准分割的方式分割图像。由于是纵向数据框架,Shi等人(2010年)的方法需要随之而来的新生儿大脑成像数据。 Liu等人(2016)研究了EM框架中基于patch的先验的使用。他们最初得出的特定于被试的图谱具有类似于Habas等人(2010b)的模板和组织概率。通过在特定于被试的图谱上进行基于patch的搜索策略来定义其他组织概率。这两个概率在空间上与patch贡献度量(基于patch及其邻域的强度结构)和基于交叉验证计算的体素标签准确性度量进行了融合。他们进一步研究了基于图谱的局部可变性在基于patch的搜索中改变搜索窗口的效果。
对成人脑分割软件的改进也已在相关文献中提出。Wang等人(2012c)将SPM分割软件改造为新生儿脑分割软件。SPM分割算法可迭代地修改概率图谱中的组织分割、偏差校正和非线性配准。SPM的组织分割方法基于EM方案,并使用ICM优化了联合代价函数。当函数收敛后,使用连通分量label进行部分容积校正。 Wu 和Avants(2012)提出了一种基于Atropos工具的技术(Avants等,2011)。EM-MRF技术与ICM参数优化一起使用。T1和T2图像均用于多元数据项。根据基于图谱的先验概率对分类错误的体素进行校正。Beare等人(2016)使用形态学操作、分水岭变换和通过扩张重建的方法,将SPM中实现的分割方法扩展到了新生儿脑分割。
c) 分类技术
Anbeek等(2008,2013)提出了一种基于k-NN分类的组织分割方法。基于训练图像的强度和空间特征,构造多维特征空间。分割是根据图像中每个体素在多维空间中与k个最近邻的亲和力来估计的。在Anbeek等人(2008)中,他们直接从图像的坐标计算空间特征。在Anbeek等人(2013)的后期工作中,他们利用平均大脑图像的空间坐标改进了空间特征的定义。Srhoj-Egekher等(2012)提出了一种基于标签融合和监督分类的方法。初始标签融合步骤的先验值与每个组织的独立2类k-NN分类的概率相结合。k-NN分类是根据T1和T2模态的强度特征进行的。最后一步是利用主成分分析得到的降维空间中的朴素贝叶斯分类器对多个组织类别的体素进行分类。Chita 等人(2013)和Moeskops 等人(2015)提出了一种多级监督分类方法用于新生儿图像的分割。图像体素分类分为三个阶段:
1. 算法的特征空间由空间特征、强度特征和当前的概率输出组成;
2. 从Moeskops等人的方法中得到T2图像的强度特征,从Chita等人的方法中得到T1和T2图像的强度特征;
3. 第一个阶段和第二个阶段分别对每个组织进行独立的2类分类,第三个阶段对所有的类都使用4类分类。Chita等人(2013)在所有阶段都使用k-NN分类器。Moeskops等人(2015)在第一阶段和第三阶段使用了k-NN分类器,在第二阶段使用了SVM分类器。采用正向特征选择方案选择各阶段的最佳特征。与Chita et al(2013)类似,Wang et al(2015)使用基于强度特征和当前概率输出的多阶段分类方案。使用这种方案,他们估计了概率图,并使用稀疏表示法对其进行了修正。使用随机森林进行分类,并在T1、T2和FA图像上进行训练。最近,Moeskops等人(2016)利用多尺度CNN分割脑组织。在采集平面上使用2D patch。在输出层中组合了多个大小的patch和卷积核,以进行最终分割。Sanroma等人(2016)将分割问题以集成的方式转换为方法的组合。他们结合了两种方法,一种是基于Wang等人(2012a)的联合标签融合方法,另一种是基于强度的方法,并在模板图像的超体素上训练了SVM。然后,他们在基于两种方法的预测和概率估计的集成方法中学习两种方法的区域加权。分类技术在新生儿组织分割挑战赛NeoBrainS12(详见9.1节)中获得了精度非常好的结果。然而,它们比参数化和非监督技术对大脑图像强度的差异更敏感。
d) 图谱融合技术
Weisenfeld等人(2006)和Weisenfeld and Warfield(2009)使用迭代样本估计过程对脑组织进行分割。最初,图谱标签被变换到被试空间,以得到被试分割的初步估计。然后,他们使用分割迭代地优化每个atlas的样本,并使用staples算法重新估计分割。他们用MRF项来模拟空间同质性。Weisenfeld和Warfield(2009)进一步采用类似于Xue等人(2007)的方法对CSF-WM 的部分容积效应进行校正。Weisenfeld和Warfield(2009)的组织分割需要精确的图谱对齐,这是一个重要的问题,因为新生儿的大脑经历了巨大的发育变化。Kim等人(2015)开发了一种用于新生儿大脑分割和表面重建的工作流程。他们采用Coupe等(2011)的基于patch的模型和Wang等人(2012a)开发的联合图谱误差估计相结合的技术对新生儿大脑进行分割。基于Wang等人(2012a)的方法,将图谱中的相似patch与联合图谱错误的加权系数进行融合。Kim等人(2015)将大脑分为两部分,皮质带以及作为一个整体的剩余大脑区域。
e) 可变形模型
Wang等人(2011)提出了一种基于局部强度信息项、图谱组织先验和皮层厚度约束的耦合水平集的分割算法。用具有空间变化均值和方差的高斯分布对局部强度信息进行建模。使用皮层厚度约束将CSF/GM和GM/WM表面距离约束在预定范围内。采用类似于Xue等(2007)的方法将CSF-WM 部分容积校正纳入模型。他们后来(Wang et al . 2012b)在多模态和纵向框架工作中扩展了他们的方法。结合使用T1、T2和FA图像进行多模态图像分割任务。此外,在不同时间点获得的图像被纳入纵向的水平集分割。采用4D配准方法对不同的时间点进行迭代配准,并根据相邻时间点的约束条件进行纵向分割。Wang 等人(2014)提出使用空间一致的特定于被试的图谱进行基于patch的分割。Wang等人(2011,2012b,2014)专注于WM、GM和CSF的分割,未将深层GM和皮层GM分离开,也没有分割脑干和小脑。
8.3. 结构分割
对大脑局部结构的绘制比较困难,这是因为缺乏细致的的手工分割图谱。早期的方法是基于人工放置在脑轴上的CGM和WM区域的分割。这些轴将CGM / WM分为16个部分:额叶、中央前、中央和枕骨区,分为左右半球的上半部和下半部。Oishi等人(2011)和Gousias等人(2012)手动描绘了大脑的第一个区域图谱。现有的分割方法使用这些图谱或从成人图谱中的label来描绘婴幼儿大脑的区域结构。使用成人大脑结构的label进行分割可能会出现问题,因为发育中的大脑可能尚未形成不同的大脑结构。图8中展示了了分割为不同结构的示例。
a) 参数化技术
Makropoulos等人(2012a,2014)利用Gousias等人(2012)的图谱通过类似于Makropoulos等人(2012b)的EM方法自动将新生儿大脑分为87个区域。 在Makropoulos等人(2014)的方法中,他们根据MR图像中的局部强度梯度将EM方法与加权标签融合相结合。Makropoulos等人(2016)扩展了Makropoulos等人(2014)中提出的方法,使用基于厚度的校正和WM-CGM边界的部分容积校正对皮质带进行了更细致的分割。Makropoulos等人(2014年)从早产儿到足月儿对不同年龄的新生儿大脑进行了分割。但是,受限于手工分割,因此提出了对早产儿大脑结构的定量评估。Wu et al(2014)从20个成人OASIS模板中将标签变换到新生儿图像上。在基于EM的初始组织分割之后,他们使用Wang等人(2012a)提出的标签融合方法将皮质带分成62个区域。
b) 图谱融合技术
Gousias等人(2013)利用了他们手动分割的图谱(Gousias et al(2012)),并研究了基于图谱的标签融合方法或最大概率图谱对齐的分割方法。标签融合需要对图谱进行精确地配准,这在不同年龄之间新生儿大脑上很难实现。
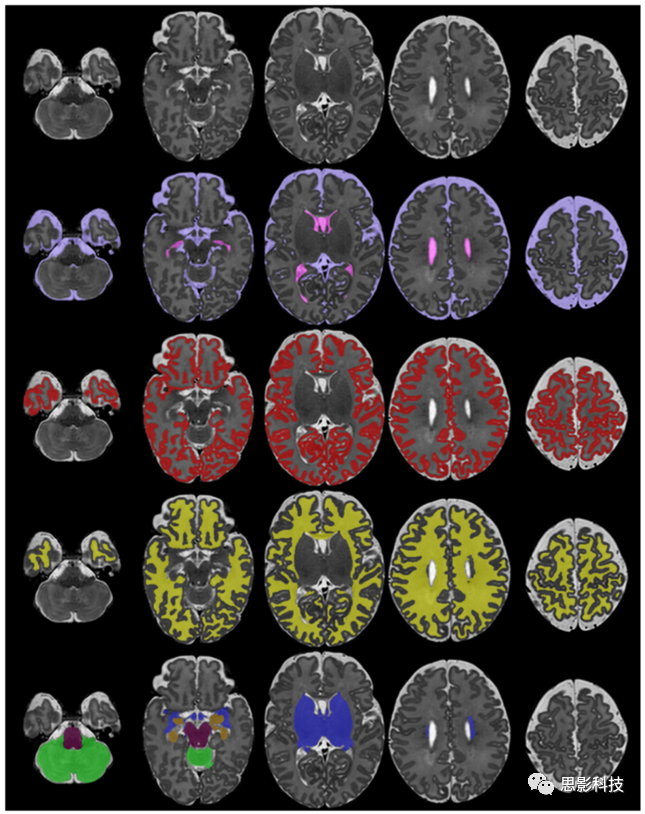
图7 使用Draw-EM的新生儿MRI的组织分割示例。
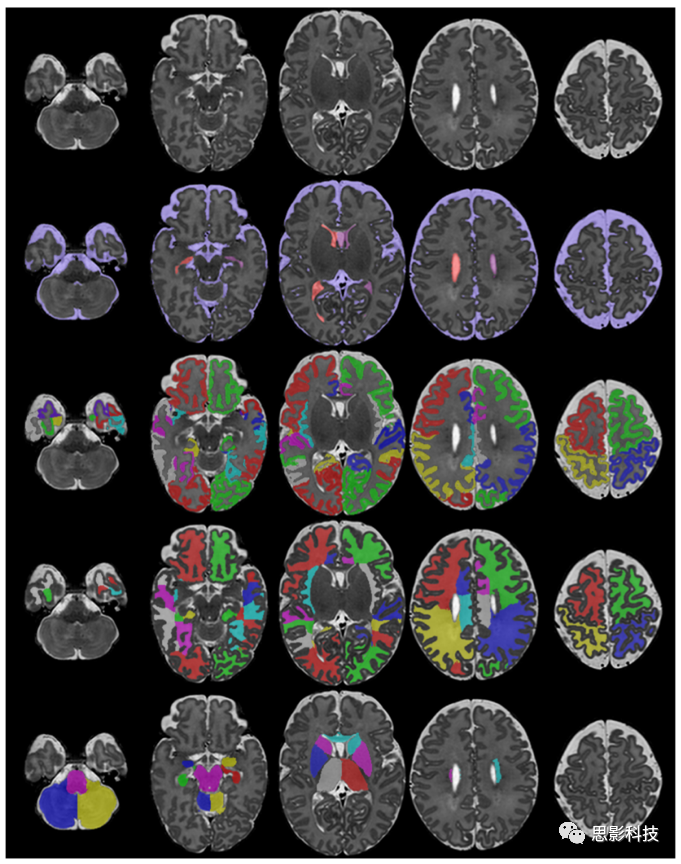
图8.使用Draw-EM的新生儿MRI结构分割的示例。
9. 评估分割方法
分割方法的准确性是根据作为“金标准”的手工标注进行定量评估。精度通常用重叠测量和/或表面距离测量来估计。胎儿和新生儿文献中最常用的重叠度量是Dice系数。在两个分割完全重合的情况下,Dice系数为1,在两个分割结果没有重合的情况下,Dice系数为0。有时会报告基于皮层表面的距离度量。一个曲面S’a和S’m之间的平均表面距离,分别由Sa和Sm的分割计算得到,定义为两个曲面对应点(如最近点)之间的平均距离。因此,计算Hausdorff距离为两个曲面对应点之间的最大距离(编者注:还有一种常用的度量是基于分割结果的modified-Hausdorff距离,这个距离度量了两个分割点集的轮廓的相似性)。
由于人工标注的数据量有限,并且围产期大脑快速发育造成的个体差异,定量评估相对有限。通常以交叉验证的方式在以手工分割的图谱作为训练数据的算法上进行评估,以比较评估自动化算法与人类专家之间的分割差异。此外,有时通过与未用于算法训练的手共分割数据进行比较来补充定量评估的结果。这些数据可以全部标记,也可以部分标记在选定的切片和/或结构上。由于不同的数据采集参数,不同的手动参考分割以及不同的结构定义和分割的结构数量,对不同的分割技术进行直接比较并不容易。为了解决这个问题并为社区提供最新技术成果,Išgum等人(2015年)在MICCAI 2012上组织了新生儿脑组织分割挑战赛NeoBrainS12。下一节简要介绍了这一挑战赛。
9.1. NeoBrainS12
最近举行的新生儿脑分割挑战赛NeoBrainS12,目的是评估提交的新生儿组织分割算法的性能。作为NeoBrainS12挑战的一部分,研究人员提供了三组不同的T1和T2图像:在校正年龄为40周时获得的轴位扫描(第1组)、在校正年龄为30周时获得的冠状位扫描(第2组)以及在校正年龄为40周时获得的冠状位扫描(第3组)。包括来自第1组和第2组的7例婴儿的影像数据,以及来自第3组的5例婴儿的影像数据。人工将大脑MR图像分为八个区域:皮质灰质(CGM)、无髓白质(WM)、有髓白质(MWM)、脑干、基底节和丘脑(BGT)、小脑、脑脊液和心室。挑战赛网页http://neobrains12.isi.uu.nl中描述了比赛的规则。 这个挑战赛包括两个阶段:挑战赛之前的一部分和on-site上的一部分。挑战赛之前的部分中提供了每组3名婴儿的数据集作为测试数据,而on-site部分则提供了每组2名婴儿的数据集,没有进行人工分割。在这些数据集上评估了算法。团队可以选择要分割的数据集和组织类型。on-site部分设置了两个小时的时间范围。提供每个第1组和第2组的两个婴儿的其余数据集作为训练数据提供,并带有手工分割。图9展示了不同方法提交到挑战赛上的图示结果。
分别对on-site部分和挑战赛前部分的分割结果进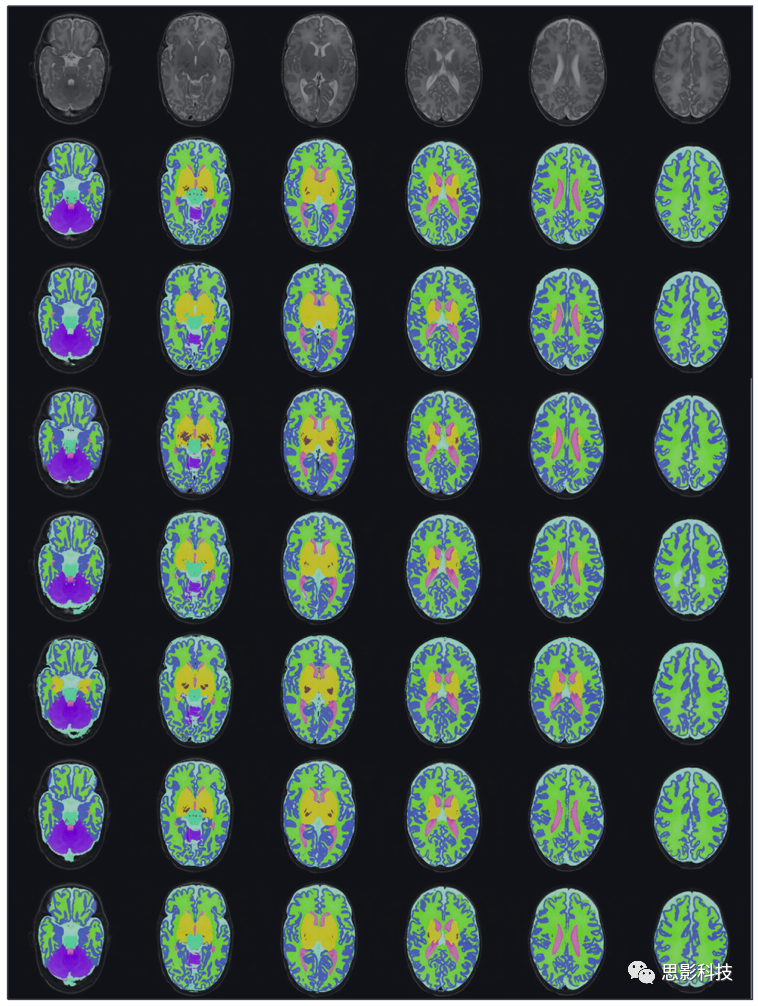 行了评估。 表4列出了不同技术得到的分割结果与手工分割标准之间的Dice系数。这里应该注意,NeoBrainS12仍然可以提交结果,并且是进行基准测试的重要资源。 自NeoBrainS12挑战赛结束以来,越来越多的研究根据挑战赛数据评估了他们的技术。所有的方法在挑战中都能得到精确的分割结果,不同组织的Dice系数位于0.71到0.95之间。唯一的例外是无法连续分割髓鞘化WM。在大多数情况下,提交的方法之间的结果差异很小。此外,由于是在有限数量的图像上进行评估(on-site每组两张图像,挑战前部分中每组三张图像),因此在NeoBrainS12中未评估分割结果精度的显著性。
行了评估。 表4列出了不同技术得到的分割结果与手工分割标准之间的Dice系数。这里应该注意,NeoBrainS12仍然可以提交结果,并且是进行基准测试的重要资源。 自NeoBrainS12挑战赛结束以来,越来越多的研究根据挑战赛数据评估了他们的技术。所有的方法在挑战中都能得到精确的分割结果,不同组织的Dice系数位于0.71到0.95之间。唯一的例外是无法连续分割髓鞘化WM。在大多数情况下,提交的方法之间的结果差异很小。此外,由于是在有限数量的图像上进行评估(on-site每组两张图像,挑战前部分中每组三张图像),因此在NeoBrainS12中未评估分割结果精度的显著性。
图9 不同技术提交到NeoBrainS12挑战赛上的分割示例。从上到下: MR图像、手动分割、Makropoulos et al (2012b)、Wang et al (2012c)、Melbourne et al (2012)、Wu and Avants (2012)、Srhoj-Egekher et al (2012)、Anbeek et al(2008)。

表4 NeoBrainS12挑战赛基于网络的结果和现场(on-site)部分的结果(数据来自http://neobrains12.isi.uu.nl)。将提交的分割结果与手工分割结果进行比较计算Dice系数。带有*的方法是在开发分割方法的期间由可用的测试集的手工分割标签数据,这些方法没有放在NeoBrainS12中的排名中。每种组织的最佳结果以粗体标出。
10. 未来的发展方向
随着人们对围产期大脑的研究兴趣日益增加以及越来越多质量好的数据可以获取,这允许我们对围产期大脑进行定量评估。尽管现在的分割技术非常成功,并且以往文献所报告的分割精度与成人大脑分割精度相似,但是仍然存在一些需要解决的问题。本节介绍围产期脑分割领域研究的现有挑战和未来方向。
10.1.图谱和可用资源
围产期脑自动分割技术发展的一个约束因素是缺乏手工分割的图谱。 目前最全面的手工分割标记图谱由Gousias等人(2012)引入。目前还没有关于早产期和胎儿大脑的详细图谱。这种图谱特别令人感兴趣,因为在此期间的大脑结构正在形成和发展。因此,将分割标签从足月变换到较早时期的方法可能需要对较小脑区进行空间映射,而不是利用观察到的解剖变异性。胎儿和早产儿的手工分割图谱将有助于进一步在早期大脑中使用自动分割方法。此外,图谱的公开可用性对于相关社区开发可用的分割方法至关重要。
脑分割技术在新生儿和胎儿领域应用有限的一个因素是缺乏可用于基准测试的公开数据库。NeoBrainS12提供了数量有限的手工标记数据,这些数据可用于评估算法在不同组织类型的分割中的准确性。对新生儿大脑和胎儿大脑的更详细结构进行类似的分割竞赛,将可以定量描述不同分割技术之间的差异。此外,使用更大量的甚至未标记的数据也可能有助于提高半监督方法的性能。大多数分割技术中使用的数据有限,部分原因是公开数据数量有限。dHCP是一个正在进行的旨在研究发育中的脑连接组的项目,它将为研究界提供大量的结构和弥散数据。需要建立类似的资源以创建可用于相关方法开发的大型数据库。最后,开放相关分割软件的源代码将允许更快地开发分割工具、大学之间的协作以及不同分割方法之间的比较。
10.2.髓鞘化白质的分割
有髓鞘和无髓鞘白质之间的区分具有重要意义。 新生儿大脑中的髓磷脂含量逐渐增加,并能使大脑中的信号传导更快。因此,它被认为与大脑的功能成熟有关。与足月儿相比,早产脑与髓鞘减少有关。只有少数研究试图区分有髓鞘和无髓鞘白质,其中大多数使用NeoBrainS12挑战赛中的有髓鞘WM数据。此问题可能还与缺少定义这些区域的手动分割图谱有关,但是无监督技术可能能够额外辅助这种区分。
10.3.分割方法
深度学习和卷积神经网络在计算机视觉领域非常流行。他们为相关的计算机视觉问题以及最近的医学成像问题方面提供了重大改进。在围产期脑分割领域中,仅在Moeskops(2016)和Rajchl(2016)的工作中中使用了CNN。半监督技术也很少被采用(Dittrich et al,2011)。对成人大脑的研究(Wolz et al,2010)表明,在分割过程中引入未标记的数据会提高分割精度。分割方法的开发另一个重要方向是对病理性大脑进行可靠的分割。胎儿和新生儿时期常见的脑部异常,例如脑室肥大或缺氧缺血性脑疾病,会严重影响已开发技术的性能。(编者注:深度学习除了在脑分割领域应用很广之外,在脑图像配准、皮层拓扑校正、去噪、去伪影头动等等方面都有很广泛的应用)
10.4.自动化分割的质量控制
自动分割方法不可能一直都完全准确。一个重要的研究方向是直接从每个分割结果中提供可靠性估计。可以开发事后解决方案以自动地对方法的分割质量进行评分,例如 基于不同分割结果之间的一致性。这将有助于识别分割方法存在的问题,并在大型临床研究中识别分割不准确的案例。
10.5.临床研究中的应用
分割的最重要目标是帮助新生儿和胎儿进行相关病理的检测和表征。使用分割技术得出的定量测量结果有可能增进对新生儿大脑疾病的了解,例如缺氧缺血性脑病、脑梗塞、脑室白细胞软化、出血和病变以及胎儿大脑的脑室肥大、皮质发育畸形。利用分割技术对正常发育中的大脑和不同病理学的定量体积测量,对于定义正常位点和识别异常标记至关重要。可以把大型数据库的公开资源用作临床研究的参考,并促进在临床实践中使用自动分割技术。此外,详细结构的DTI和fMRI测量可用于进一步扩展此资源。 尽管进行此类分析的前提是需要开发健壮的方法以及相关方法的质量控制流程。
10.6.从新生儿过渡到成人
还需要细致划分的大脑结构,从而将新生儿大脑、胎儿大脑到成年期大脑的结构发育联系起来。Alexander等人(2016)构建的图谱为在新生儿期大脑和成年期大脑之间建立这种联系提供了重要资源。Alexander等人(2016)根据Desikan Killiany协议(Desikan et al,2006)描绘了新生儿大脑中的皮质结构,该协议通常用于成年大脑的皮层划分的研究。此外,de Macedo Rodrigues等人(2015)的图谱将2岁以下的新生儿大脑和婴儿大脑分割成32个区域,从而可以将婴儿期的脑发育联通起来。Shi等人(2010)和Wang等人(2012b)开发纵向分割方法对于在不同的时间点一致地分割结构很重要。在此应注意,等强度阶段(约6-8个月)获得的婴儿大脑MRI分割特别具有挑战性,因为这个时期的WM和CGM强度分布具有很明显的重叠。解决此问题的方法很有限。
11. 总结
随着能够获得更好质量的图像并且越来越多人关注胎儿和新生儿发育,胎儿和新生儿大脑的分割越来越引起人们的兴趣。在这篇综述文章中,作者调查了与胎儿和新生儿大脑MRI分割相关的文献。作者首先介绍了脑分割领域(尤其是围产期大脑)面临的困难。因此介绍了用作先验知识的脑图谱。接下来是对图像采集和图像预处理技术的简要说明,这些技术在分割之前用于减少由于运动、噪声和强度不均匀而导致的图像伪影。他们根据目标人群、分割任务和方法类型对不同的分割方法进行了描述。他们提出了用于评估分割质量的评估指标,并介绍了NeoBrainS12(一种新生儿脑分割挑战赛),它经常被用作新生儿组织分割方法的基准。最后,介绍了该领域尚存的挑战和未来可能的方向。由于缺乏数据,相关方法的开发仍然存在困难。但是,随着围产期大脑数据资源的累计,预计在不久的将来将克服这些问题。未来的方法应该对处于发育中的大脑或者存在病理特征的大脑的分割具有鲁棒性。 这将允许对病理病例进行细致的研究,并有可能允许在临床实践中使用自动分割方法。 一句话总结:本文结合围产期胎儿、新生儿MRI所面临的挑战(伪迹多、信号差、个体差异大等),从图谱到脑组织提取到分割,比较全面地综述了现有的围产期脑影像分割算法,在方法学上比较有借鉴意义。

微信扫码或者长按选择识别关注思影
如对思影课程感兴趣也可微信号siyingyxf或18983979082咨询。觉得有帮助,给个转发,或许身边的朋友正需要。请直接点击下文文字即可浏览思影科技其他课程及数据处理服务,欢迎报名与咨询,目前全部课程均开放报名,报名后我们会第一时间联系,并保留名额。
更新通知:第十届脑影像机器学习班(已确定)
磁共振脑影像结构班(预报名)
弥散磁共振成像数据处理提高班(预报名)
小动物磁共振脑影像数据处理班(预报名)
更新通知:第二十届脑电数据处理中级班(已确定)
脑电信号数据处理提高班(预报名)
眼动数据处理班(预报名)
近红外脑功能数据处理班(预报名)
数据处理业务介绍:
招聘及产品:
招聘:脑影像数据处理工程师(重庆&南京)