Angelman综合症(AS,Angelman syndrome)是一种神经发育障碍,其特征在于智力残疾、语言和运动障碍、癫痫、睡眠异常以及自闭症的多种表征。患有AS的个体显示出特征性的EEG模式,包括高振幅有节奏δ波。Hanna den Bakker等人尝试定量研究AS已知频段以外的EEG结构表征。自闭症患者的功能连接和睡眠锭的异常表现促使Hanna den Bakker等学者进一步寻找AS儿童表现在EEG上的量化指标,本研究便是建立在对一批AS(Angelman综合症)和NT(正常儿童)的EEG数据进行再分析的研究。文章发表在Molecular Autism。
方法
Hanna den Bakker等人分析了AS儿童(4-11岁)和年龄匹配的神经发育正常者的回顾性唤醒和睡眠EEG。通过测量清醒状态和睡眠期间多个频率的相干来评估长程(long-range)和短程(short-range)的功能连接,并分别使用了计算机自动识别和专家经验性地挑选识别了睡眠锭进行分析。
结果
清醒状态下,AS儿童在整个频率范围内均表现出较强的长程相干。睡眠期间,患有AS的儿童表现出远程相干性增强,γ频段尤为明显。并且AS儿童在睡眠状态下睡眠锭的出现频率和持续时间均低于NT(正常儿童)。
结论
AS在伽马波的相干和睡眠锭两个指标上存在失调,并且在清醒状态下的功能连接存在异常。这种脑电的定量指标可在未来的临床实验中作为生物标志物,用以提供有关AS儿童神经回路失调的线索。
关键词:Angelman综合症,UBE3A,EEG,相干,睡眠锭
研究背景
Angelman综合症(AS)是一种由遗传性UBE3A基因的神经元表达缺失引起的神经发育障碍,AS的症状包括严重智力障碍、语言和运动功能受损、癫痫、睡眠异常,其中部分与自闭症的表现重叠。其一致而且普遍存在的脑电异常包括癫痫样放电,间歇性θ波和增强的节律性δ波,在先前的研究中Hanna den Bakker等人确定了定量方法可以成功地应用于回顾性脑电图数据,以佐证之前关于AS节律性δ波的临床结果。为了在脑电数据中量化异常指标,作者进一步分析了清醒状态和非快速眼动睡眠期间(NREM,后文中的睡眠状态指此状态)的脑电相干值以及NREM的睡眠锭。
相干是衡量两点同时记录脑电信号相关的一种指标,是一种无侵入的评估功能连接的方法,作者在观察过自闭症个体的相干值以后决定研究AS的相干。自闭症已被认为是AS的组成,包括UBE3A在内的15q11-13染色体区域的拷贝数增加也与综合症自闭症相关。有数据表明,大约50-80%的AS患者符合自闭症的诊断标准;但是,由于很难通过AS个体的标准化临床测试来评估自闭症,因此这些估算值之间存在很大差异。通常观点认为自闭症患者在相邻电极对之间具有较高的相干性(局部超连通性),而在长距离信号之间具有较低的相干性(全局低连通性),但是近年来这种观点受到了质疑并渐渐有所改变。因此,尽管具体的连接方式尚不清楚,但人们普遍认为自闭症EEG的相干表现异常。基于AS和自闭症的相似程度如此之高,作者提出假设:AS儿童的相干值也可能存在异常。
睡眠异常在AS患者中很常见,并且在该疾病的小鼠模型中也有报道,包括易惊醒和睡眠时间过短,这对AS儿童和他们的监护人的生活质量造成了影响。作者试图确定AS儿童中睡眠中断的定量的脑电信号特征。除了测量睡眠期间的相干外,还量化了睡眠锭。睡眠锭是NREM睡眠期间在sigma波段(〜11–16 Hz)中的丘脑皮质振荡,对于记忆巩固非常重要。而在许多神经发育和神经退行性疾病(例如自闭症、智力障碍、癫痫症、阿尔茨海默氏病和精神分裂症)中,睡眠锭活动减少。作者假设定量测量可以揭示睡眠锭和睡眠期间相干的细微损害,而这些损害在临床EEG中可能很难手动检测到。
作者在清醒状态中报告AS儿童相干增强,睡眠状态只在gamma波段的长程存在这种增强。还发现了睡眠锭更少更短的情况。这提供了AS的生物标志物并有希望在未来成为治疗的靶标,因此这是一个探索性的研究,为了进一步探究AS的相干和睡眠锭的异常,并且将这些EEG特征和AS行为结果相关联。
方法
研究设计
分析确诊为AS和年龄匹配的正常对照(NT)儿童的EEG数据。所有的EEG研究均在哈佛医学院和圣地亚哥UC的机构审查委员会(IRB)的批准下进行,并同意参加。在先前的研究中,已对所有EEG数据进行了频谱分析,它检验了AS的δ波增强的预设。作者在此基础上进行了一项探索性研究用来识别可以定量的EEG异常表现。
数据来源
从圣地亚哥雷迪儿童医院的获得28名AS儿童(14男,14女)和马萨诸塞州综合医院的72名NT(正常发育)儿童(42男,30女)的静息态数据,所有儿童的年龄均为4-11岁(AS 5.8±0.3岁,NT 7.0 ±0.2年)。一位经验丰富的临床神经生理学家评估了所有记录的睡眠/清醒状态,并将数据分类为清醒状态和NREM睡眠时期。快速眼动睡眠时期和状态不明确的数据段则被剔除。将数据分为清醒状态和NERM状态两个数据集分别进行分析。
数据采集和预处理
使用Bio-Logic或Xltek系统,并在10-20电极的标准位置上,使用200至512Hz之间的采样率采集EEG。使用Sidorov等人所述的方法对所有数据进行了预处理。使用相同的方法对NT和AS脑电图进行并行预处理,以限制在两个站点记录对数据造成的影响。简单的说,预处理采用的是双侧乳突做重参考,滤波(带通滤波1-100hz,凹陷滤波60hz),清醒与睡眠的分离,伪迹校正。
相干分析
分别在清醒时间段(图2,附加文件1:图S1)和NREM睡眠时间段(图3和附加文件,图S2)进行了组一致性比较(AS与NT)。对每个EEG记录数据,计算150个电极对组合*100个频率点(1-50hz,每0.5hz一个频率点取100个频率点)。取2s一个时间段,50%重叠度的时间窗,然后用mscohere函数针对每个窗口计算相干,并在每个频率下‘x’和‘y’的对应程序使用welch平均修正周期图来对这些窗口求一个平均值。根据信号x,Pxx(f)和y,Pyy(f)的特定频率密度以及x和y的交叉频率密度来计算信号x和y的相干值Cxy(f), Pxy(f):
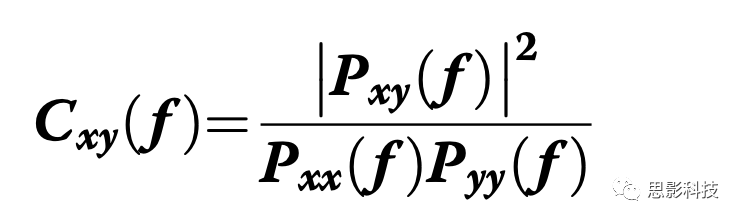
由于睡眠/唤醒分别编码和伪迹去除,预处理的EEG信号是不连续的。因此预处理数据的每个片段中分别计算了相干性,然后在加权片段长度的同时对不同片段的平均相干性进行了计算。仅对超过10 s的连续数据作相干分析。
为了简化每个记录的14500个相干测量的解释(145个电极对×100个频率点),用了两种方式对数据进行分组:(1)按频率和(2)按电极位置。
1. 频率分组
将δ分组并定义为 2-4 Hz, θ定义为4-7 Hz, α定义为8-12 Hz, β定义为12-30 Hz, γ定义为30-50 Hz,同时为了确保统计的正常性,先对每个来自0.5 Hz频点的相干值(R2)进行Fisher-z转换,这样Z分数是五个感兴趣频段中的每个平均值中得出的。然后使用Fisher逆函数对这些平均分数进行逆变换,以获得每个电极对每个频段一个相干值的z分数。
2. 位置分组
根据电极对之间的距离(长程和短程)和相对位置(半球内和半球间)将电极对分组。为了按距离对电极对进行分组,布置了电极(图1a)变成网格(图 1b),为每个电极分配坐标(例如,对于F7为(2,1)),并使用MATLAB函数pdist []计算所有坐标对之间的欧式距离。坐标“ a”和“ b” 的平方欧式距离(d2 )用以下公式计算,其中x a 是 “ a”和y的x坐标,而y a是“ a”的y坐标:
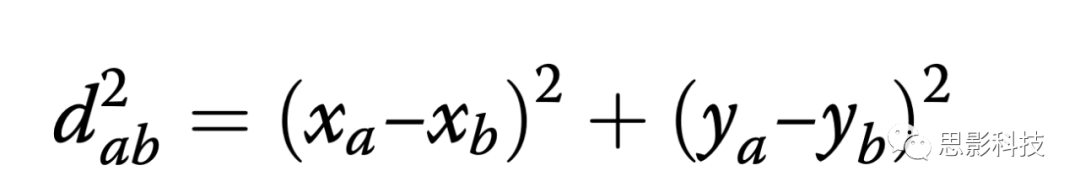
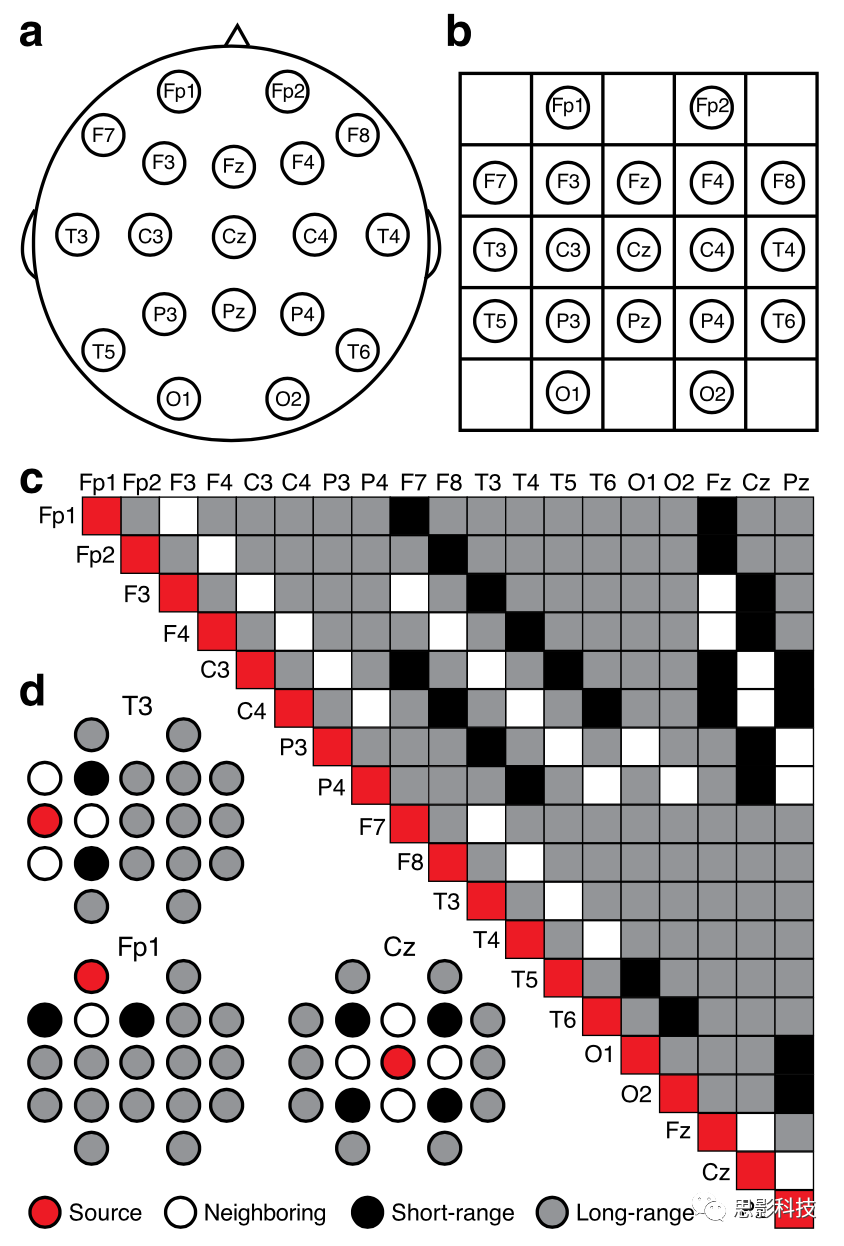
图1 用于相干性分析的长距离和短距离电极对。标准的10-20脑电图电极放置在a头皮上,b网格上。c将所有电极对分为短距离(黑色)和长距离(灰色)。相邻电极对(白色)被排除在分析之外。d源电极(红色)的三个例子及其与所有其他电极的关系。
然后根据算得的欧氏距离将电极对分为短程电极对(d 2 = 2)和长程电极对(d 2> 2)(图1c–d)。并将直接相邻(d2=1)的电极从分析中删除以避免容积效应的干扰。再对五个频段中每个频段内的所有短距离电极对(n = 24)和所有长距离电极对(n = 121)以及整个频段(从1到50 Hz)的z相干值进行平均(见图2和图3)。在比较半球内相干和半球间相干时(附加文件1:图S1B-G,附加文件2:图S2B-G),将半球内分析限制为长距离电极对,因为根据定义,所有半球内电极对是远程的。这种方法消除了半球内数据而不是半球间数据中短距离对的潜在混淆。再从半球内-半球间分析中排除了包含一个或多个中线电极(Fz,Cz,Pz)的所有电极对。最后创建了地形相干图(图2e和3e,附加文件1:图S1D,S1G,附加文件2:图S2A,S2D,S2G)来表示相干的空间分布。这些图用彩色编码线覆盖10–20电极放置系统,该彩色编码线指示每个电极对之间的相干(所有对象的平均值)为了进一步评估AS中相干表型的空间分布作者通过单个节点(电极)和节点组计算了相干性(附加文件1:图S1H–I,附加文件2:图S2H–I)。首先,对于每个电极,我们对所有远程连接的相干值求平均值。接下来,我们对每个空间定义的电极组(frontal:Fp1,Fp2,F3,F4,F7,F8,Fz;中央:C3,C4,Cz;时间:T4,T5,T6;central)的这些单个电极平均值求平均:P3,P4,Pz;occipital:O1,O2)。
补充图1
补充图2
高频伪迹的识别和去除
作者在没有关于特定频段内相干的预设的前提下进行了相干分析,并且发现,患有AS的儿童在γ波段的远程相干的确有增强(见图3)。然而在此频段下肌电会干扰γ波相干的精确分析。因此,除了在数据预处理的初始阶段手动去除伪迹外,作者还进行了事后分析以识别睡眠EEG数据中难以视觉识别的低振幅EMG(肌电)伪迹。根据频谱功率通常遵循的频率反比(〜1 / f)衰减规律,作者排除了在电极中对数功率与频率(在30–50和65–95 Hz之间)关系的线性拟合斜率超过− 1的极端值。排除了一个AS异常值和一个NT异常值,在这些异常值中,肌肉伪影可能会破坏对高频相干的解释。将这些事后分析仅限于睡眠EEG,因为清醒状态下EEG中相干的改变并非限于γ频段,因此不太可能受到高频EMG伪影的影响。
考虑容积传导
为了最大可能减少容积传导效应对结果的干扰:
1. 删除了相邻电极对的分析
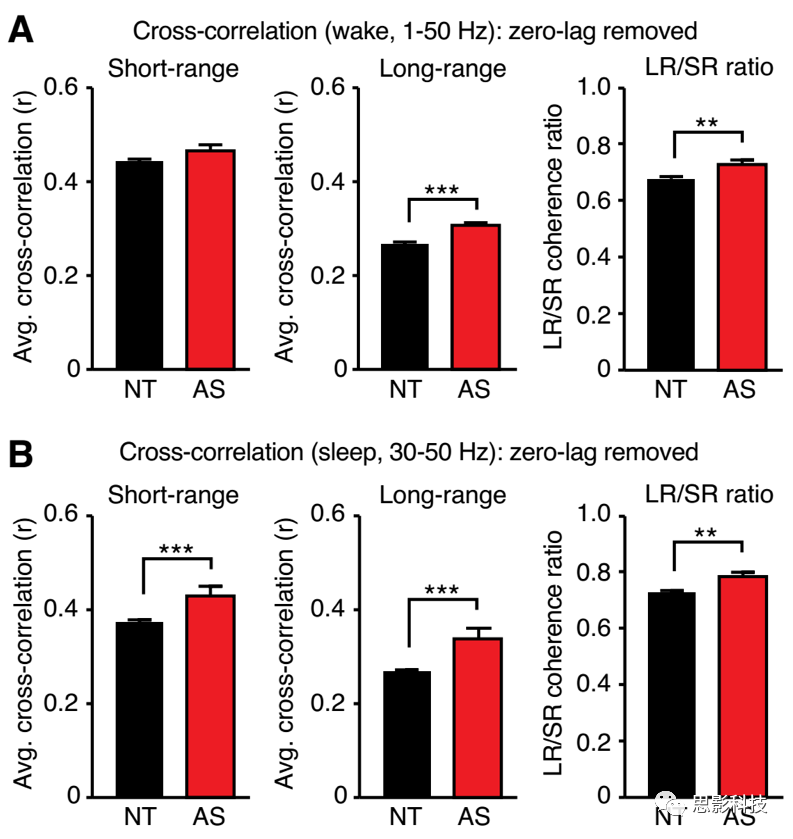
2. 删除了所有电极之间零延迟的相干(附加文件 3:图S3)。
3. 用其它单元的平均值做交叉相关。
4.进行互相关分析并将远距离和短距离电极对分组之前,我们对带通滤波的唤醒数据(1–50 Hz)和睡眠数据(30–50 Hz)进行了带通滤波。
补充图3
频谱分析
分析了4-50hz而非1-50hz,并且采用的分辨率是0.5hz一个区间,进行标准化,以解决AS儿童的强的delta能量值(2-4 Hz)。因此,图4a表示与附加文件3数据相同。
睡眠波检测
使用了计算机自动检测和临床专家盲测相结合的方式,自动检测的工具是matlab,方法如下:
1.预处理后的数据标准化为90-100 Hz频率范围的平均功率。该信号(图4d,顶部面板)
2.使用10阶Butterworth带通滤波器在11 Hz和16 Hz之间对数据进行滤波
3.进行希尔波特变换计算瞬时振幅,并使用40 ms的高斯核对瞬时振幅进行平滑处理
4.幅值超过平均幅值的5.5倍就会被检测为睡眠锭,而当一个睡眠锭被检测到,它的持续时间从幅值超过平均幅值的2.5倍的时候开始算起(见图4d),在0.4-2.0s间才能够被算作睡眠锭
5.分析19个通道的睡眠锭的频率和持续时间,相隔不到300ms的睡眠锭算作一个以防止重复计算,同时排除了两个没有发现睡眠锭的AS儿童数据。
人工检测
两名受过训练的临床专家(DJL和ZF)在不清楚是AS还是NT的情况下手动分析了所有睡眠EEG中的睡眠锭(图4f)。为了确保专家保持盲性,作者在手动编码之前用5 Hz高通滤波器滤除了AS中非常普遍的背景变化量。专家们指出了纺锤出现的时间以及从背景活动(高,中,低)手动检测睡眠锭的置信度。
统计分析
工具是GraphPad Prism 7,见图:
1. 使用t检验来评估不同型的相干,并用二阶方差分析评估不同频段对相干值的贡献
2. 使用t检验评估去除容积效应以后的交叉相干(见补充文件图S3)
3. 用t检验比较了频谱能量,组水平睡眠锭的频率和持续时间
4. 使用双尾fisher校验比较了手动的睡眠锭检测,清醒状态1-50hz的长程和短程的相干值之比的效应量、睡眠锭的比率和delta波在所有电极点的平均值。
结果
计算了个体19个电极点之间的145种组合的相干值,并分为长程和短程,比较了AS组和NT组,1-50hz之间的相干值,评估了所关注的五个频段(δ,θ,α,β,γ)分别对应的相干值,采用了Bonferroni的多重比较校验。还分别分析了清醒阶段(NT:n = 54;AS:n = 26)和NREM睡眠阶段(NT:n = 54;AS:n = 13)的相干值,得到的结果:
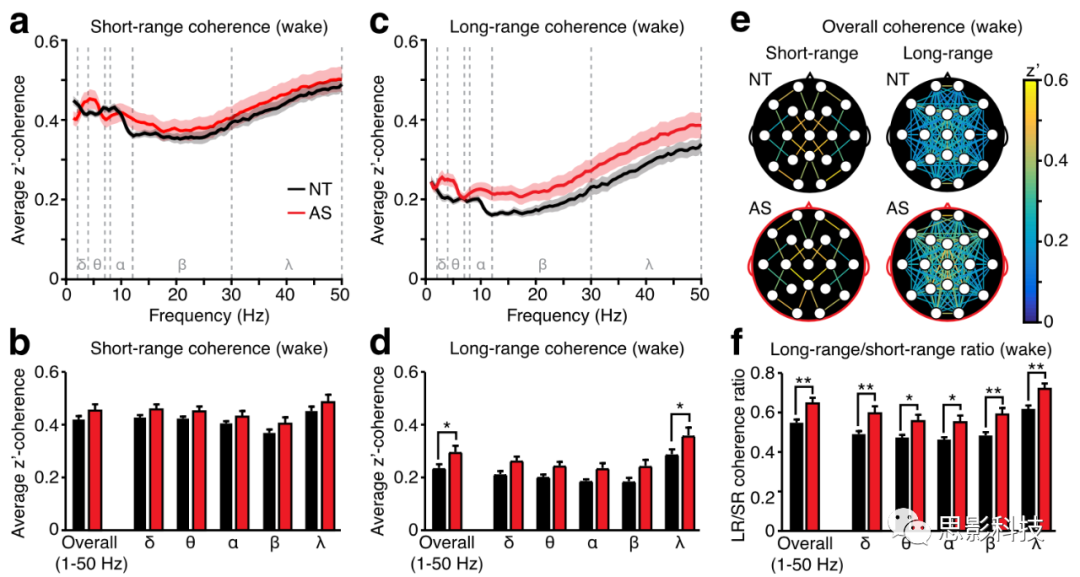
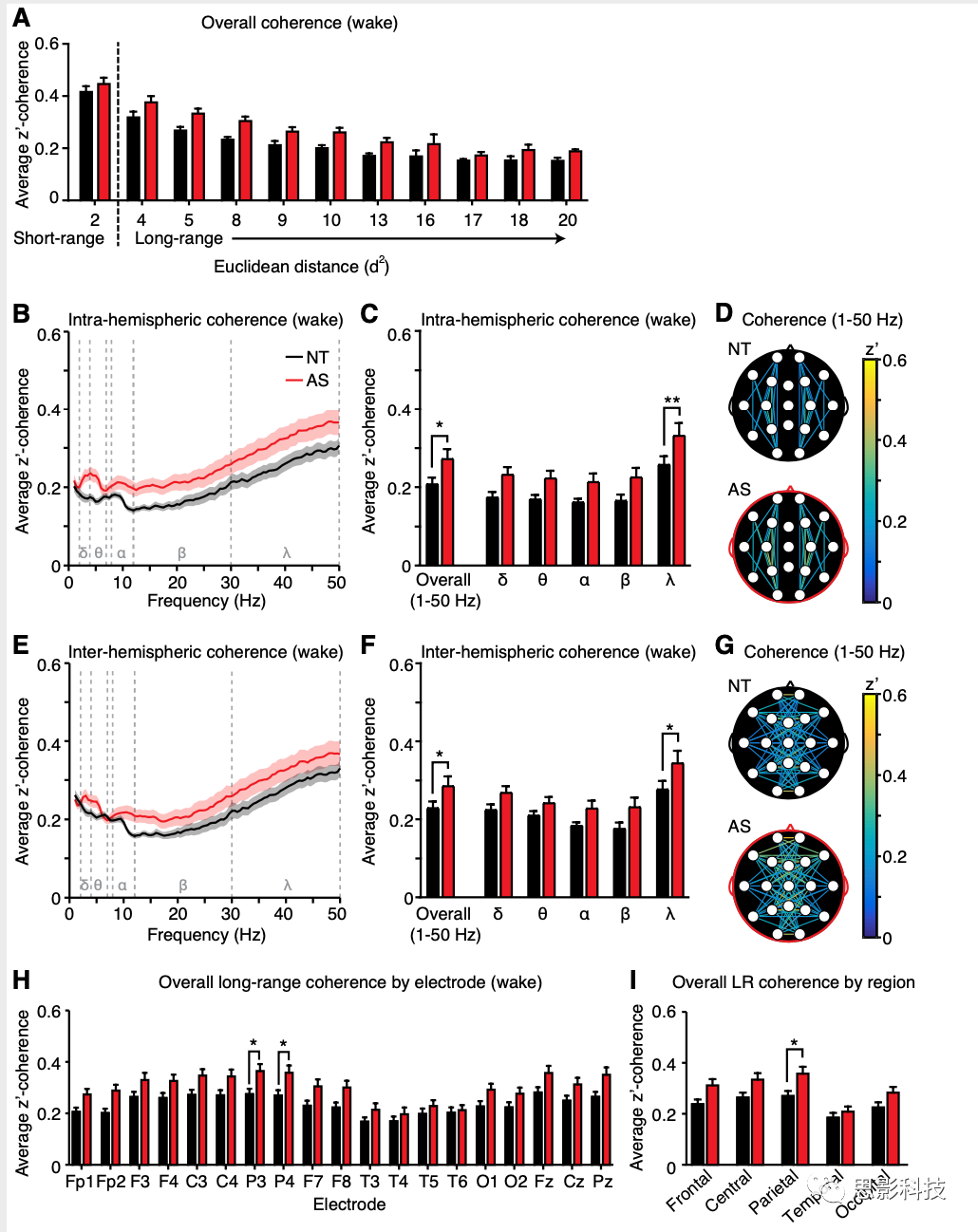
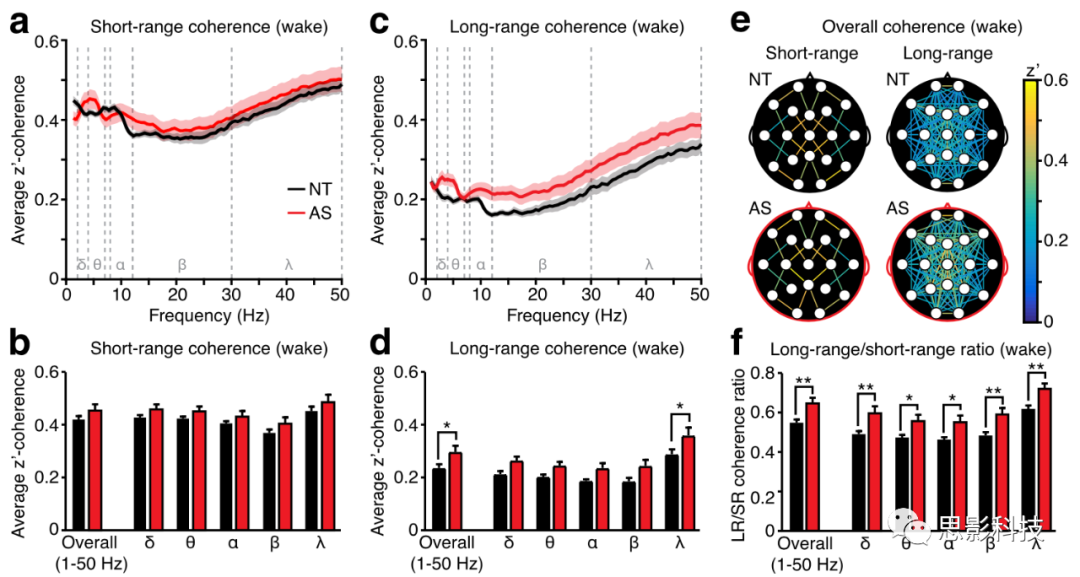
图2:清醒状态下AS的长程相干增强。
a) 特定δ、θ、α、β、γ的平均短距离相干性。
b )所有频率和各频率段短距离相干性。
c )所有频率的平均长距离相干性。
d )整体和按频率分组的长距离相干性。
e )相干地形图,颅表上每对短距离和长距离电极之间的整体相干性。
f )AS长距离相干性比短距离相干性显著提高。NT(黑色):n=54,AS(红色):n=26
清醒状态下长程相干增强
清醒状态,整体的短程相干值并未出现差异,五种频段也没有出现和表征上的交互作用。(图2a,图2b)。而在长程上的相干值上,患有AS的儿童总体相干值呈现显著增加的(图2c,图2d;p = 0.0207),在二阶方差分析中,AS的表征主效应显著(F(1,390)= 28.11, p <0.0001),但是没有表征×频率的相互作用(F(4,390)= 0.3385 , p =0.9224)。虽然在γ波段内统计地检测到了较高的长程相干,但是缺乏表征和频段的交互作用。并且通过所有电极点相干的地形图(图2e)得到结果就是AS的长程相干是在广泛分布于全脑的。可以的结论是,AS觉醒期间增强的长程相干广泛分布在全脑的,而并不仅限于某些电极对。
在多重比较中,作者从频段上发现了明显的组间主效应(见图2a和2b),在接下来比较长程相干是否相对于短程相干的变化有所增加,发现AS组与NT组之间相比,长程与短程的相干值之比有明显的增加。进行二阶方差分析时,表征(AS/NT)呈现出明显的主效应(F (1,390)=48.39, p < 0.0001),但是在表征和频率之间没有交互效应(F (4,390)= 0.1083, p = 0.9796),并且这个比率在每个频率都有所增加,说明长程相干值异常是分布于各种频率的。
睡眠状态下长程相干增强
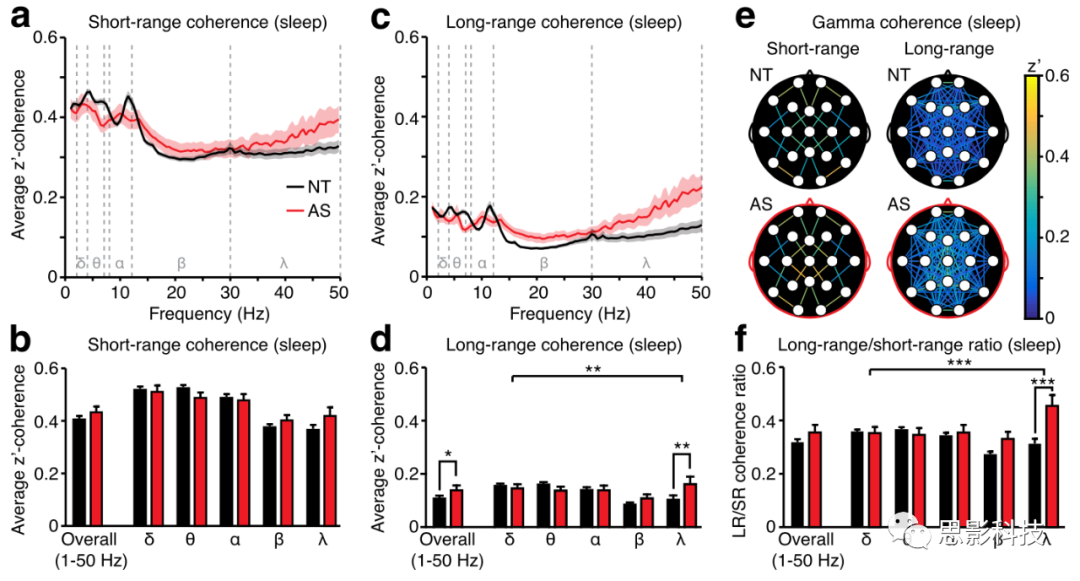
图3:睡眠状态AS的长程相干在γ频段较强。
a )特定δ、θ、α、β、γ的平均短距离相干性。
b )所有频率和不同频率短距离相干性。
c )所有频率的平均长距离相干性。
d )整体和按频率分组的长距离相干性。
e )γ相干地形图。
f )相对于短距离相干性,AS的γ长距离相干性增加。NT(黑色):n=53,AS(红色):n=12
在睡眠期间,AS个体和NT个体的短程相干值并无明显差异,二阶方差分析也没有出现主效应或是交互效应。在睡眠期间,频段上显示AS组相对于NT组长程相干有显著增强,不同于清醒状态,睡眠状态的长程相干的增强主要来自于γ频段(图3d),全脑相干值的地形图也显示睡眠状态中,γ频段的相干普遍得到了增强(而不仅仅是某些区域或者电极对)。
尽管睡眠中个体间长程和短程相干之比没有显著增加,但是在二阶方差分析中表征×频率呈现较明显的交互作用(F (4,315) = 5.946, p = 0.0001),事后检验发现是γ谱带的相干增强了(见图3f; δ, θ, α: p > 0.9999, β: p = 0.1796, γ: p < 0.0001)。排除肌电干扰以后确定是γ频段的相干值增强了,作者通过测试容积传导,删除零延迟的相干等较为保守的方法消除容积效应的影响以后得到的结果与上面一致,证实了以上差异并非容积效应造成的结果。
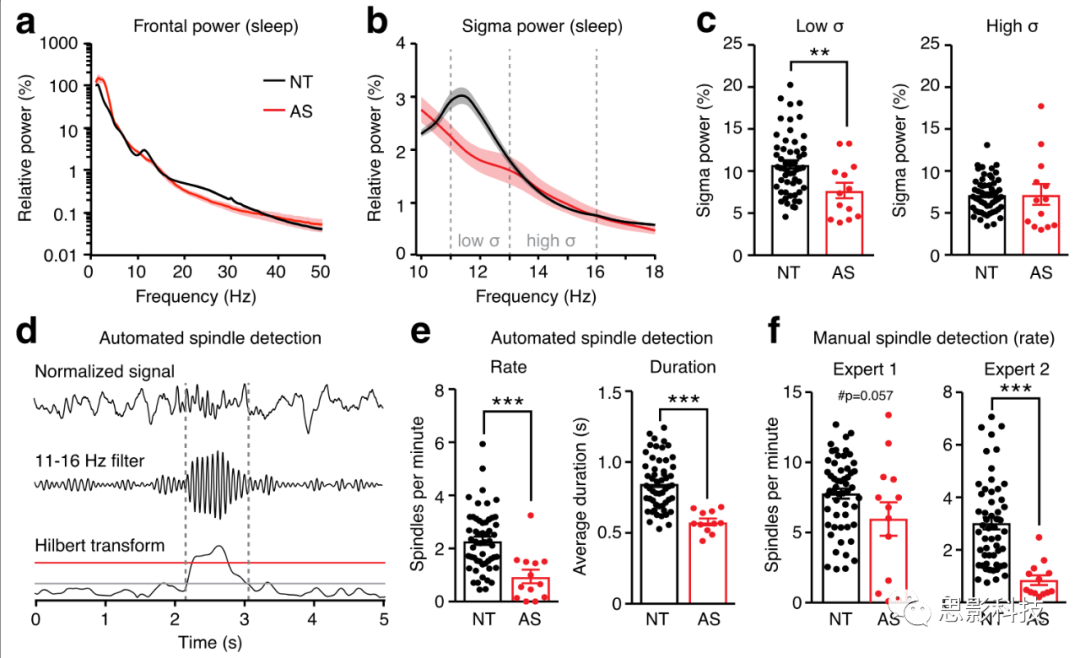
图4 AS儿童睡眠锭减少。
额叶电极上(a)所有频率(1-50Hz)和(b) σ频率的活动。
(c) 睡眠锭发生时,AS儿童低σ(11-13hz)活动降低。
(d) 睡眠锭自动检测步骤:标准化信号(上)后进行滤波(中)并进行Hilbert变换以计算瞬时振幅(下)。上阈值(红色)用于检测睡眠锭,下阈值(灰色)用于定义睡眠锭持续时间。
(e)自动化检测的睡眠锭频次(NT:n=54,AS:n=13)和持续时间在AS儿童组(NT:n=54,AS:n=11)降低。
(f)两名对组别不了解的专家手动检测纺锤波。
AS组的睡眠锭的出现频率和持续时间减少
睡眠锭是人在NREM期间θ波段同步增强的结果。在正常组的睡眠状态可以发现局部θ波的峰值,而在清醒状态下却没有,这种峰值可能是睡眠锭的标志。而在AS组中没有发现θ相干的峰值,这意味着AS组的睡眠锭可能有所减少。睡眠锭的密度还与NREM睡眠时θ谱带能量峰值有关,而AS组θ谱带的频谱能量也降低了。总体而言,AS组在θ波上的相干值和谱带能量都间接说明了其在睡眠锭上的失调。作者同时还使用了自动识别和专家人家识别的方法来识别睡眠锭,并且同时证明了AS儿童比NT儿童的睡眠锭要更加少。
δ波有着比睡眠锭和相干失调更大的效应量
比较过以上结果和之前对于AS有着更高的δ波能量的研究发现,作为未来临床量化研究AS的生物标志物和靶标时,基于可靠性的考虑,比较了各表征的效应量发现(见表1),δ波能量的增高是评估AS最可靠的表现型。
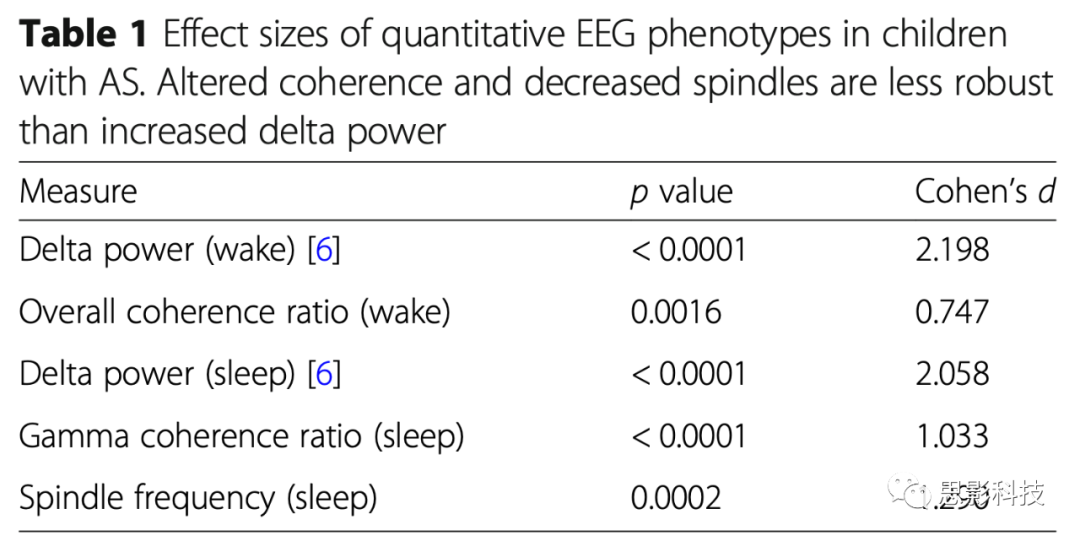
表1:EEG不同表征在AS上的效应量
讨论
作者的定量研究了揭示了三种指标:
1. 清醒状态下长程相干增强
2. 睡眠状态中γ频段相干增强
3. 睡眠锭的频率和持续时间降低
清醒期间AS儿童的长程相干跨越多频率得到增强,研究的结果显示AS的长程相干在全脑区域都是有增强的,前人普遍认为自闭症的功能连通性是失调的,AS有自闭症的状态,并且也存在相干失调的脑电表征。而结合先前关于AS患者的功能连接减弱的研究,可以想见虽然AS患者的大脑功能连接减弱,但是AS脑中投射的抑制信号也相对较少。因此有着正常的δ的相干值.
而在睡眠状态下,AS儿童的长程相干仅在γ频段显著提高。γ频段是注意力清醒的标志,因此,通常睡眠阶段的γ频段的相干值都会较低。被证实NT儿童的γ波段相干值在睡眠状态是低于清醒状态的,而AS儿童的睡眠状态γ频段却维持在清醒状态的水平。总的说,在清醒状态和睡眠状态下,AS儿童的EEG功能连接都显著增强,但是相干模式不同:清醒状态是全频率的增强,而睡眠状态则是在γ频段表现突出。因此在评估功能连接中要控制睡眠状态。
研究还发现AS的睡眠锭较常人更短,出现频次更低,这与自闭症,智力障碍和睡眠障碍者的睡眠锭失调现象一致。
研究中的不足:
本次实验使用的是回顾性EEG数据重新分析,没有严格意义上的控制好睡眠状态的变量,而因为AS患者往往伴有睡眠障碍,实验数据中,AS的入睡率(46%)明显低于正常儿童(75%),今后在进行相关研究中可以考虑进行整晚睡眠脑电的采集以增加结果的可信度。
总结
作者在对AS儿童进行EEG数据分析的探索性分析中,提出了三种新的的定量EEG指标。这些结果作为生物标志物和和研究神经基质都具有潜在的价值。需要进一步的工作来确认独立样本中的发现,尤其是在明确研究睡眠的条件下。

微信扫码或者长按选择识别关注思影
如对思影课程感兴趣也可微信号siyingyxf或18983979082咨询。觉得有帮助,给个转发,或许身边的朋友正需要。请直接点击下文文字即可浏览思影科技其他课程及数据处理服务,欢迎报名与咨询,目前全部课程均开放报名,报名后我们会第一时间联系,并保留名额。
更新通知:第十届脑影像机器学习班(已确定)
磁共振脑影像结构班(预报名)
弥散磁共振成像数据处理提高班(预报名)
小动物磁共振脑影像数据处理班(预报名)
更新通知:第二十届脑电数据处理中级班(已确定)
脑电信号数据处理提高班(预报名)
眼动数据处理班(预报名)
近红外脑功能数据处理班(预报名)
数据处理业务介绍:
招聘及产品:
招聘:脑影像数据处理工程师(重庆&南京)