经颅磁刺激(transcranial magnetic stimulation, TMS)是一种非侵入性调节大脑活动和行为的方法,但是其效果在不同的研究和个体之间仍然存在很大差异,从而限制其在研究或临床中的大规模应用。本文中作者发现低频TMS刺激对感知(sensory)区域和认知(cognitive)区域的功能连接有相反的影响,进而通过生物物理模型确定了这些区域特异性作用的神经机制:额叶皮层的TMS刺激减弱了局部抑制(local inhibition)并破坏了前馈(feedforward)和反馈(feedback)连接,而枕叶皮质的TMS刺激增强了局部抑制及正向信号传导。
最后,作者将功能整合(functional integration)网络的宏观网络参数作为特征预测在个体水平特定脑区的刺激效果。总而言之,本文揭示了TMS的调控效应如何取决于目标区域的连通性分布,并提出了一种提高无创性大脑刺激技术在研究和临床应用中的敏感性的影像学标记物。本文作者来自德国慕尼黑大学,发表在期刊SCIENCE ADVANCES上。
引言
经颅磁刺激TMS是一种非侵入性调节大脑活动和行为的方法,可以用于测试大脑活动与感觉运动加工之间的因果关系以及调控复杂的认知功能(例如记忆),并逐步在临床中得到应用。通过一系列电磁脉冲刺激皮层的rTMS已经被用于监测和改善神经和精神系统疾病,美国食品药品监督管理局最近才批准rTMS作为重度抑郁症的治疗选择。
rTMS的影响不可否认,但是其效应的可重复性在不同个体之间存在很大差异,这可能是由刺激的异质生理效应和各种可用的刺激方案所致的。本文集中于在运动系统广泛应用的抑制性rTMS,即使用连续的1 Hz刺激或theta(~5 Hz)频率脉冲降低神经元的兴奋性。但是最近有文献报道,上述两个脉冲方式可以增强大脑活动。总之,rTMS的抑制作用似乎还没有推广到运动区域之外的其他皮层区域,尚且不清楚为什么相同的刺激方法会产生相反的效应。作者假设rTMS调制的方向主要取决于刺激区域的连接性及其潜在的细胞组成。
用TMS刺激大脑皮层表面可调控使用不同的神经递质、执行不同的动作并对刺激具有不同敏感性的神经元群。细胞数据显示,rTMS能调节γ-氨基丁酸能(GABA)神经元和谷氨酸能神经元的兴奋性,因此根据局部细胞组成具有不同的区域效应。1Hz的rTMS增加了与突触可塑性和GABA产生酶有关的基因表达,以及系统水平的GABA能神经传递。
由于TMS的电磁场跨越了几平方厘米的皮层区域,相同的刺激方法会诱导不同的早期基因表达,并且并非所有的区域都对磁刺激做出同样的反应。为了提高TMS的特异性和可重复性,需要一种关于大脑刺激的跨尺度理论,其中要考虑到区域异质性和潜在的神经生理学。
为了满足上述需求,作者将宏观脑成像与正向连接(通常是兴奋性)、反向(通常是抑制性)连接的生成模型相结合。fMRI通过功能连接来识别两个皮层区域之间的交流,图论方法在更全局的交互层次上捕获区域的功能整合。有研究者则使用生成模型来解释fMRI信号背后的内源性大脑活动,其中频谱动态因果模型(DCM)取决于分布式神经元网络或graph中耦合的(固有的)神经元波动的生物物理模型。
作者们认为关于rTMS的频率依赖性效应的关键假设并未推广至整个大脑中。基于较高认知和初级感觉皮层的异质连通性分布,作者在全局尺度上将细胞间隔的计算模型与功能网络整合进行整合,在整个大脑皮层系统地比较了1-Hz刺激对微观和宏观信号的跨尺度影响。
总之,作者的研究主要考察的是:
(1)考虑到宏观大脑结构的个体差异,在个体水平确定TMS刺激区域至关重要;
(2)相同TMS方法刺激感觉区域和认知区域在整个皮层是否产生相反的扩散效应;
(3)扩散效应是否可能来自于TMS刺激区域的反馈和前馈连接的异质性。
方法
被试
27名健康(无任何精神疾病)的右利手被试参与该实验(14名女性,平均年龄25.56,SD = 3.01),所有被试均了解研究目的和潜在的风险,并签署了书面同意书。该研究得到当地机构审查委员会的批准,并根据赫尔辛基宣言进行。
脑刺激
使用带有导航的Nexstim eXimia系统(version 4.3)及双相八字形线圈进行rTMS。在每个session之前,使用每个被试的结构像(T1)建立神经导航系统,从而通过红外摄像机连续跟踪线圈确定相对于单个目标区域的位置(光学导航)。
利用最大似然算法,通过映射表面肌肉电极(Neuroline 720)和集成的肌电图设备记录的右拇短展肌的皮层表征来确定每个被试的静息运动阈值(resting motor thresholds, rMT)。rTMS的目标区域由刺激前(preTMS)fMRI数据的网络分析得到。低频rTMS的频率为1 Hz,刺激强度为被试rMT的100%(平均rMT = 34.4%,SD = 7.5%),每个区域刺激20分钟(总共1200个rTMS脉冲)。在刺激过程中,将线圈垂直于颅骨表面放置,使用可调线圈架保持感应电场的前后方向。
影像学数据采集
使用配置有32通道头部线圈的3T Philips Ingenia磁共振扫描仪采集了preTMS和post TMS的多频带fMRI数据:40层,采用了multiband的采集方法(即一次触发多次扫描,从而缩短扫描的TR,这里是一次扫描两次), TR = 1250 ms, TE = 30 ms, FA = 70°, FOV = 192 mm × 192 mm, matrix size = 64 × 64, voxel size = 3 mm × 3 mm × 3 mm。每个run持续12.35分钟,收集600个volumes。
每个被试均采集了T1像:170 层, TR = 9 ms, TE = 3.98 ms, FA = 8°, FOV = 256 mm × 256 mm; matrix size = 256 × 256; voxel size = 1 mm × 1 mm × 1 mm。在fMRI数据采集过程中,磁共振扫描室变暗,要求被试睁开眼睛并保持清醒,使用MR兼容的红外摄像头监视他们的眼睛。
影像学数据分析处理
本文的原始影像学数据和分析脚本存储在OpenNEURO的在线库中,以便进行重复和进一步分析。使用用于连接组分析的pipeline对结构像和功能像数据进行分析。图面板中的大脑表示是借助Nilearn库(nilearn.github.io)和Caret软件(brainvis.wustl.edu)创建的。
结构数据预处理
使用AFNI-3dSkullStrip对结构像数据进行颅骨剥离,使用FSL划分为三种组织类型,并从FSL提供的标准空间限制单个被试的组织分割。然后,分别使用FMRIB的线性图像配准工具(FLIRT)和FMRIB的非线性图像配准工具(FNIRT)对上述图像进行线性和非线性配准,进而标准到MNI空间(各向同性2 mm)。
功能数据预处理
使用AFNI-3dvolreg对功能像进行时间层校正、头动校正,使用AFNI-3dAutomask剥离颅骨;对全局平均强度进行标准化、nuisance信号回归、带通滤波(0.01-0.1Hz),其中使用二次和线性detrending进行去线性趋势,使用来自于白质和脑脊液体素时间序列的具有最大方差的五个主成分对生理噪声建模并进行去回归;通过基于线性变换的FSL-FLIRT将预处理后的图像配准到结构空间,该线性变换基于从白质组织分割得到的白质边界信息;使用Friston-24参数对头动建模;将上述图像变换到MNI空间用于组水平的统计。如果下面没有特殊说明,则fMRI分析均在个体进行。
TMS目标区域的确定
使用FLS的melodic功能对preTMS的fMRI数据进行独立成分分析(ICA),分解为17个空间成分; 计算每个ICA与Yeo等人17个网络模板集中的IC_08(FRO)、IC_01(OCC)、IC_14(CTR)成分之间的空间互相关;从每个匹配的ICA映射中提取覆盖左半球背侧前额叶皮层(FRO)、枕极(OCC)和颞上回(CTR)的目标区域,并将其投射到个体空间作为TMS目标区域。 功能连接分析计算种子区域与其他voxel时间序列之间的Pearson相关得到功能连接。为了最小化每个被试的连接模式的误差,以每个被试的TMS区域为种子点(5mm球形半径)在个体水平计算功能连接。将每个被试preTMS功能连接数据平均以实现每个被试稳健的基线功能连接模式。在组水平的统计分析之前,将功能连接map标准化到MNI空间、进行z变换、最后进行空间平滑(FWHM 6 mm3)。
一致性模块分析(Consensus modularity analysis)
使用MATLAB 2015b和Brain Connectivity Toolbox进行一致性模块分析,使用Gephi软件对模块化分解进行可视化:
(1)使用独立的atlas在个体水平计算无阈值的功能连接矩阵。从atlas选择了与组水平灰质mask以及任何认知网络template共享的节点(5毫米的球形区域),提取了保留的79个节点的时间序列,基于成对的Pearson相关系数建立互相关矩阵,将负相关值以及位于20毫米半径内的节点之间的值归零,然后做Fisher z变换。
(2)在个体水平进行一致性模块分析。将Louvain算法用于community检测并重复1000次,并创建一个单独的共分类矩阵表示将节点共分类到同一模块的频率。按照已有研究,设定一致性划分阈值τ= 0.4并重复100次,图5给出了不同τ值的结果。
(3)使用上述参数对各个共分类矩阵进行了second-level共识模块化分析。该分析的结果是每个条件的组水平共分类矩阵和两个模块化参数、分类一致性(z)和分类多样性(h),表示节点在整个graph中的局部整合和全局整合。
局部信号分析
计算TMS位点的ALFFs、ReHo及每个voxel时间序列的SD。其中,ALFF是通过计算未经滤波处理的图像0.01-0.1Hz频带内的总功率;ReHo是计算当前voxel与相邻27个voxel时间序列的Kendall相关。上述两个指标均是在原始空间计算然后变换到MNI空间,并用6 mm3的高斯平滑核进行空间平滑。
频谱DCM
使用SPM12中的DCM12计算DCM。将功能连接性显著改变的voxel投射到到模板网络上,并确定了受rTMS影响的8个子网络(visual网络R1、R2;背侧注意网络R5、R6;凸显网络R7、R8;中央执行网络R12、R13);在个体空间提取每一个子网络平均fMRI信号时间序列,为其指定一个完全连接的DCM(动态因果模型)模型以比较网络交互的所有可能的嵌套模型;使用频谱DCM估算模型,该频谱使用内源性神经元波动的幂律模型拟合复杂的交叉频谱密度。
统计分析、
单变量体素分析
使用SPM12在群组水平对功能连接、ALFF、ReHo及SD进行单样本t检验或单因素ANOVA。在“flexible factor design”中将“participates”设定为被试间因子,将“condition”(preTMS, FRO-TMS, VIS-TMS, and CTR-TMS)设定为被试内因子。统计检验限定于所有被试的平均灰质mask,FEW校验,cluster水平p<0.05。
模块化分析
使用置换检验在三个水平上验证模块分解:
(1)每个被试未经阈值化的功能连接矩阵;
(2)每个被试的共同分类矩阵;
(3)组水平的共同分类矩阵。置换操作5000次,生成中值Q值的零分布,我们将其与每个条件下观察到的样本中值Q的大小进行比较。使用Wilcoxon符号秩检验(p <0.05)来评估TMS对局部和全局整合参数的影响。
分类
作者使用scikit-learn库中的随机森林进行分类。特征中包含了所有皮层节点(Power等人的模板,N=151)preTMS与postTMS的差异h,这样可以避免特征选择的偏倚。h的计算是基于被试的共分类矩阵和作为模块隶属关系的功率网络分配,从而避免了从测试集到训练集的信息泄漏。使用嵌套交叉验证和内部验证方法评估随机森林分类器的超参数优化的分类器性能:树的最大深度,特征数量以及叶节点处所需的最大样本量和最小样本量。置换检验5000(p <0.05)对类别标签进行随机化验证得到的准确率。
DCM的PEB框架
使用PEB流程进行组级推断,考虑了每个连接的预期强度和相关的不确定性,评估了每个被试的连接与组水平均值的关系。首先创建了三个单独的PEB模型,在8个子网络中检查基线(preTMS)的定向连接与OCC-TMS和FRO-TMS的定向连接的改变;接下来使用贝叶斯模型测试每个完整PEB模型中的所有嵌套模型并“修剪”连接参数;将最佳256个修剪模型的参数平均,然后根据贝叶斯模型平均加权生成连接参数的组水平估计;最后,作者比较了使用自由能的模型,并计算了每个模型的后验概率(> 0.95),作为对数贝叶斯因子的softmax函数。
结果
如图1A所示,作者采集了27名被试每个session中TMS刺激前(preTMS)和TMS刺激后(postTMS)的fMRI数据。在两次fMRI采集之间,每个被试在磁共振扫描室外均接受了前额叶区域(FRO)、枕叶区域(OCC)和颞顶区域(CTR)的20分钟的rTMS刺激。rTMS刺激后与postTMS的fMRI采集之间有较短的过度时间(mean = 5.87 min, SD = 1.1 min),且在session之间没有差异[F(2,44) = 3.24, P > 0.05]。23名被试纳入最终的数据分析。
首先,作者分析了数据的质量,定义了可接受的信噪比[SNR(t): mean = 6.6, SD = 1.0]和头动(FD: mean = 0.13 mm, SD = 0.03 mm),不同session之间不存在差异[SNR(t): F(3,66) = 1.01, P > 0.05; FD: F(3,66) = 0.44, P > 0.05]。接着,验证了单独定义的目标区域是否包含于额叶(粉红色)和视觉(紫色)模板网络。
图1所示为对preTMS fMRI的功能连接分析统计后得到的显著性区域。总而言之,可以看出本文在个体水平上刺激了正确定位在感知(visual)和认知(frontal)网络以及与各种网络存在连接的控制区域。
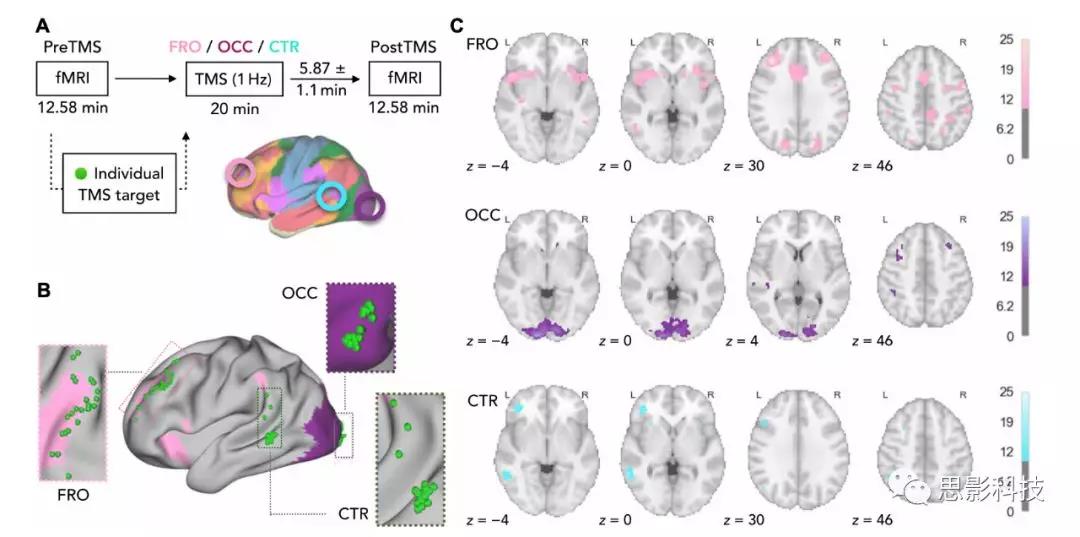
图1 研究设计
(A)每个被试在3天内进行3次TMS-fMRI试验。每个位点(FRO、OCC、CTR)均接受20min、1Hz的rTMS刺激,分别采集TMS刺激前、后的fMRI数据。
(B)对每个被试TMS刺激前(preTMS)的fMRI数据进行功能网络分析得到各自的TMS刺激区域(绿色小球所示)。
(C)群组水平TMS目标区域内preTMS fMRI数据的功能网络。
相同刺激方法的异质扩散效应
作者检查了rTMS对每一个目标区域的扩散效应,在OCC-TMS和FRO-TMS中发现了相反的效应,即OCC-TMS直接增强了目标区域OCC功能连接的同时间接增强了非目标区域FRO的功能连接,而FRO-TMS直接减弱目标区域FRO及间接减弱了非目标区域OCC的功能连接,CTR-TMS无影响。简言之,OCC-TMS影响在空间上更局限,而FRO-TMS影响在空间上更广泛,与刺激位点一致,左半球的功能连接变化多于右半球(图2A,紫色),刺激效果对目标区域或其相关网络不是空间选择性的,而是分布在多个模板网络上(图2B)。总之,相同的刺激对感知区域(OCC)和认知区域(FRO)的功能连接具有相反的影响,并传播到各种功能网络。
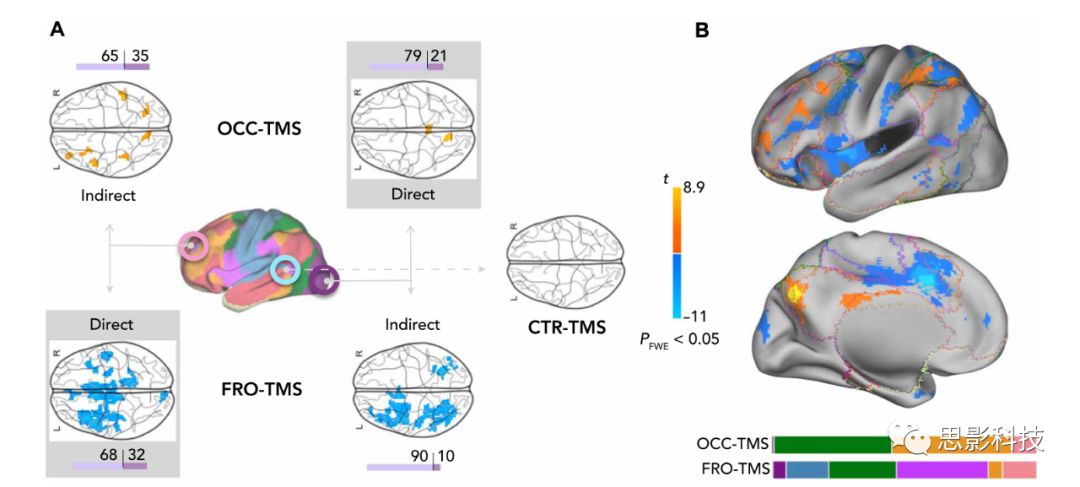
图2 TMS对大脑功能连接的相反效应
(A)统计图所示为OCC-TMS, FRO-TMS和CTR-TMS后全脑功能连接显著变化的区域。OCC-TMS增强了目标区域OCC(直接)及非目标区域FRO的功能连接(间接);相反,FRO-TMS减弱目标区域FRO及非目标区域OCC的功能连接;未观测到CTR-TMS及CTR区域的功能连接变化。
(B)左图所示的全脑功能连接变化的总结。
rTMS刺激对全局整合的影响
作者接下来在整个皮层研究了rTMS对大脑功能整合的影响,如图3A所示,通过共识模块分析确定每个节点的局部整合强度(z)和全局整合强度(h)。结果显示三个水平下(个体的功能连接矩阵、个体共分类矩阵、群组共分类矩阵),始终能够在所有rTMS条件下找到三个比随机网络模块化程度更高的模块(见fig.S3)。如图3B所示,在preTMS中,FRO位点比OCC位点有更高的全局整合强度(hFRO = 0.76 ± 013; hOCC = 0.65 ± 0.19; P = 0.01),表明FRO位点中绿色和蓝色模块之间的全局整合能力。
如图3C和3D所示,rTMS显著地改变网络的整体拓扑,OCC-TMS使模块分布更平衡、等距,表明红色和蓝色模块之间的交换相对增加;FRO-TMS使绿色和蓝色模块移得更远,表明节点之间的功能连接性不一致。
定量分析显示,OCC-TMS增加了OCC区域(图3C, 黄色圈, hpre = 0.65, hpost = 0.88)及整个网络(hpre = 0.80 ± 0.12,hpost = 0.83 ± 0.07, P = 0.004)的全局整合。此外,FRO-TMS后有变化的所有体素的hpre均高于OCC-TMS后有变化的体素(图3D, P = 0.00004),这表明受FRO-TMS影响的所有区域在基线时已经更加整合,也可以解释为什么刺激在全局水平更广泛地影响成对的连接。总之,对基线下低全局整合的感知节点(OCC)的刺激可能会通过直接连接到全局整合节点来增加全脑互动,但是基线下全局整合程度高的额叶节点的TMS刺激对全脑整合没有影响,可能是因为最初的高水平密集连接抑制了刺激效果。
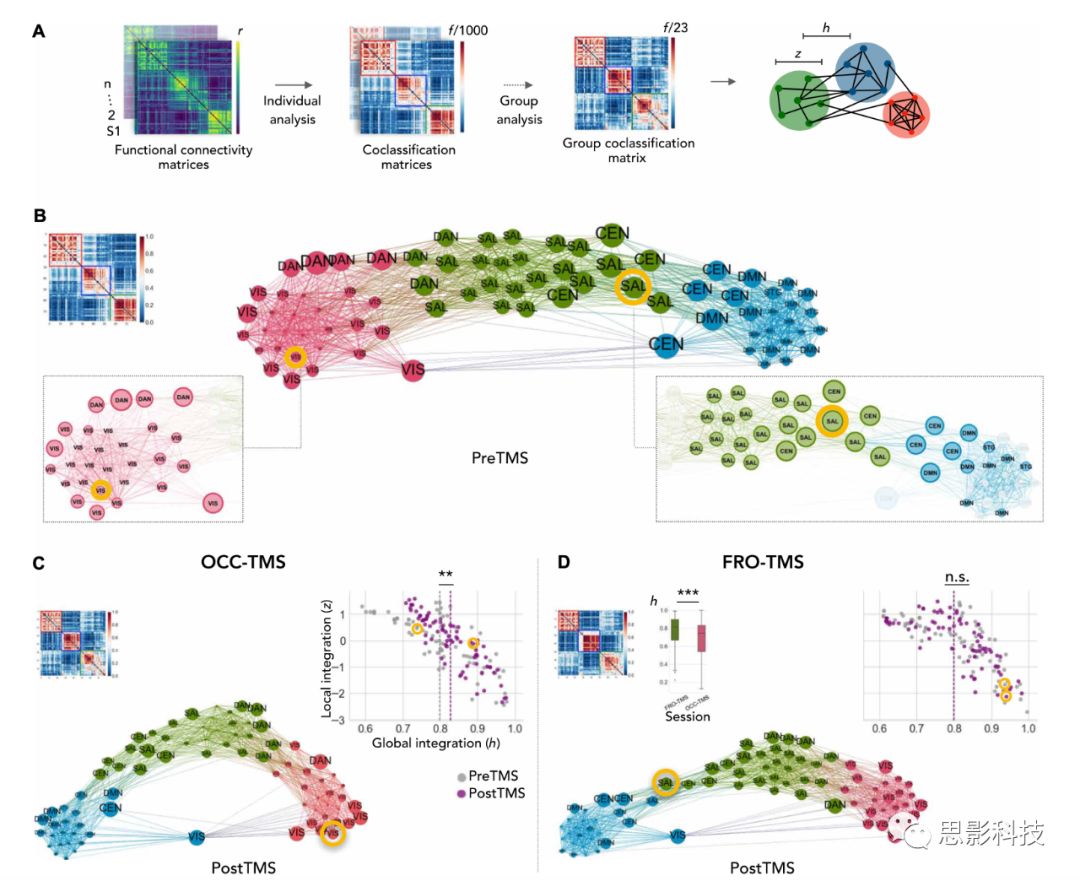
图3 rTMS对全局功能整合的影响
(A)在个体和群组水平的共识性模块分析得出每个节点局部功能整合参数(z)和全局功能整合参数(h)
(B)左:群组平均的共分类矩阵,中:preTMS拓扑表征。高共分类值的节点彼此接近,节点大小用h表示。节点颜色表示模块化从属关系。OCC-TMS (C)和FRO-TMS(D)后的群组平均的共分类矩阵、拓扑表征,OCC-TMS增加了OCC及全脑的功能整合。
大脑功能整合作为rTMS传播效应的预测指标
如图4所示,基于随机森林分类器,全局功能整合对刺激效应分类的整体准确率为67%,p = 0.028 [OCC-TMS = 65%; FRO-TMS = 70%; 95% CI = 53 to 80%];支持向量机分类器的准确率为65% (OCC-TMS = 65%; FRO-TMS = 65%; 95% CI = 51 to 78%; fig. S4)。图4B为h的区域分布,表明大脑分为两部分。与OCC相似,感知运动皮层、初级整合皮层(VIS、SM、DAN)h指数较低,额顶皮层、高级认知网络(SAL、CEN)有较高的h指数。总之,全局整合显示整个大脑皮层分为两部分,这可能会预测感觉和认知区域对低频刺激的不同反应。
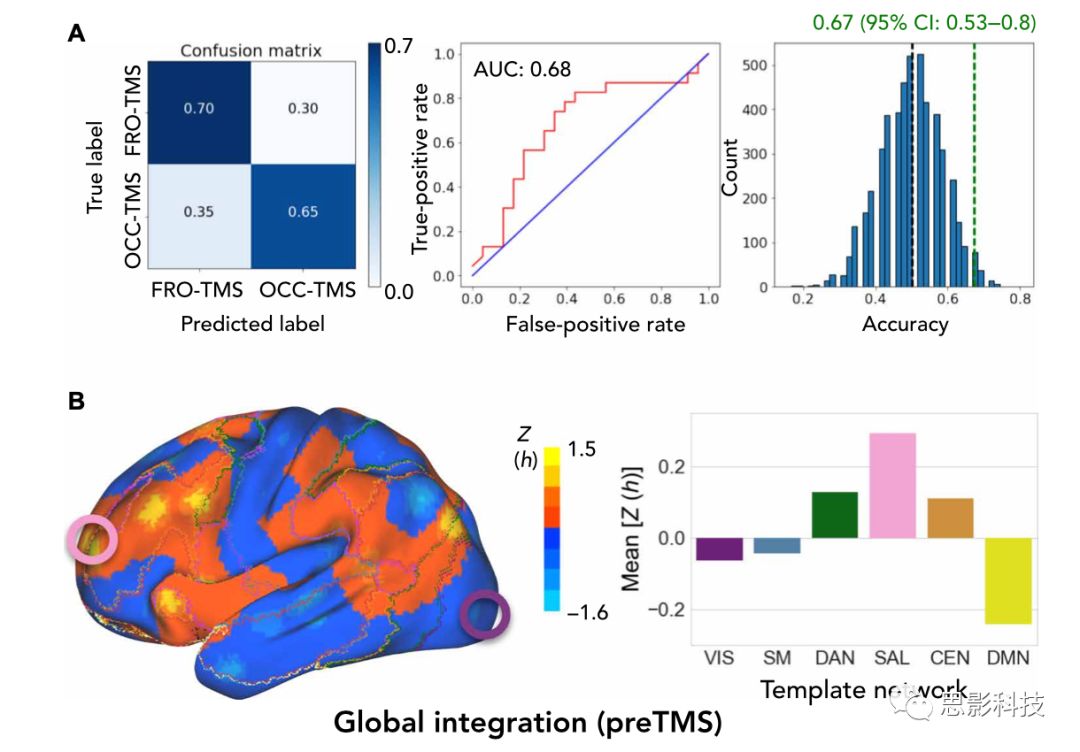
图4 大脑功能整合是TMS传播作用的预测标记物
(A)全局功能整合h值对OCC-和FRO-TMS进行单独分类可产生67%的整体预测精度。
(B)左图:整个大脑皮层全局功能整合h的空间分布分布,右图:模板中各网络的全局功能h值。
rTMS不影响大脑局部活动
rTMS的远程影响可能仅与目标区域的局部信号变化有关,这最终会影响该区域的任何功能连接指标。如图5所示,目标区域的ALFFs、ReHo及SD不存在rTMS效应(P > 0.05),这表明相比于目标区域的局部信号,rTMS更影响远程功能连接。

图5 rTMS不影响大脑局部活动
条形图表示rTMS目标区域内fMRI信号平均的ALFF、ReHo及SD,这三个指标在rTMS前后不存在显著差异。
全局刺激效应的生物物理模拟
最后作者使用频谱DCM(静息态数据分析中常用,可一次模拟所有模型)来表征2个子功能网络的局部抑制性连接和远程兴奋性连接的神经动力学。如图6A所示,结果发现枕叶-顶叶区域之间相互连接的平衡结构,此外沿着感知、顶叶整合和额叶认知区的解剖轴存在特定的前馈(绿色)和反馈(黄色)连接。
图6B所示为OCC-TMS后直接连接的群组差异,OCC刺激增强了枕叶皮层的局部抑制(R1: +0.13),并将有向连接的平衡转移至顶叶和额叶皮质的前馈信号(反馈减少R1: -0.14,R6: -0.10;前馈增加R2: 0.10)。图6C所示为额叶皮层的局部抑制降低(R8:-0.10)和16个有向通路中的11个解偶联,刺激同样影响前馈和反馈连接。该分析通过前馈和反馈连接方面的非对称皮质层次生成模型扩展了功能连接变化的模式。枕叶区域的TMS刺激促进沿视觉通路的前向信号传递,而FRO-TMS甚至在较远脑区也导致双向通路的解耦联(即耦联的减低)。
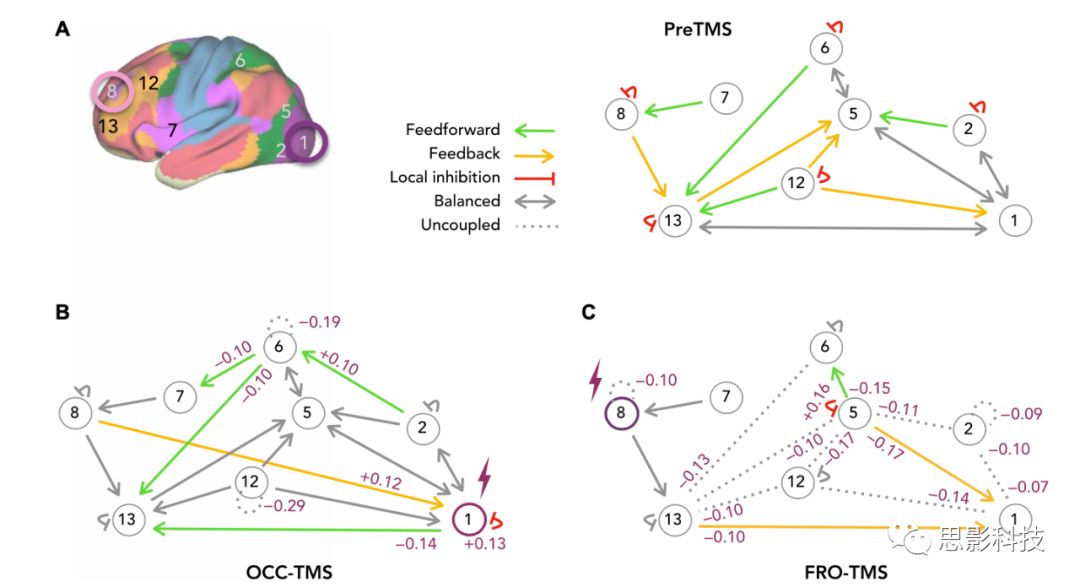
图6 刺激效应对有向信号的生物物理模型
(A)我们使用频谱DCM对功能连接变化的区域之间的有向信号进行建模,包含局部抑制信号(红色)、兴奋性前馈信号(绿色)和抑制性反馈信号(黄色)。连接模式说明了沿人类大脑皮层前后(左右)轴的有向信号传递。preTMS模型指示特定的前馈、反馈和平衡的(灰色)连接通路。
(B)OCC-TMS增强了枕叶区域(R1和R2)和顶叶区域(R6)的前馈信号。
(C)FRO-TMS破坏了16个有向通路中的11个(虚线),同样影响前馈和反馈连接。
讨论
TMS的神经调控已经引起了广泛的关注,为非侵入性调控神经精神疾病异常的大脑活动提供了可能,但是较弱调控效果、较低的可重复性限制其应用。本文发现,TMS刺激区域的连接状况会从根本上影响调制方向,这是对皮层刺激或抑制具有特定刺激频率以及调控作用在不同的大脑状态存在差异的一般性假设的重要扩展。
研究发现:
(1)相同的1 Hz刺激对感觉区域和认知区域的宏观网络信号具有部分相反的影响;
(2)生成模型表明局部抑制和远程兴奋的异质细胞负责这些不同的响应;
(3)宏观尺度上的功能整合是预测区域对低频刺激的可靠参数。上述发现为人类大脑的异质信号结构提供了实验证据,并建议在估算区域TMS刺激效应时考虑微观和宏观连接。
本文最重要的发现,1 Hz的rTMS刺激感觉(枕叶)皮层和额叶皮层对该区域的远程通讯具有相反的调控作用,因为普遍认为抑制性rTMS会降低神经元兴奋性且与作用位置无关,同样其他几个研究同样报道了1 Hz或theta burst刺激增加了各个皮层区域的活动。本文的结果表明,rTMS的调控效果在整个皮层上存在差异,取决于目标区域的功能整合程度,而并不是TMS刺激的频率范围。
rTMS在各个区域的刺激极大地超出了该区域和相关的功能网络,这种远程影响与使用TMS调控静息态功能连接的研究一致。此外,研究发现TMS刺激区域的fMRI局部信号没有变化。枕叶刺激沿着背侧视觉通络扩散到顶叶和额叶区域,而额叶刺激降低了与突显网络(覆盖额叶刺激区域)和整个皮层网络的功能连接,这意味着本文确定了感知区域刺激后特定效应的二分法以及额叶区域刺激后广泛的影响,这反映了通过计算模型和纤维追踪研究建立的人类皮层中发散和收敛的信号传导层次。虽然rTMS在识别并调控特定功能通路中很有前景,但是需要注意扩散效应并不仅仅局限于感兴趣网络。
并且,结果表明宏观尺度上的功能整合是预测特定的刺激反应模式的有效标记物。在整个大脑皮层中,功能整合始终能够区分感知系统和高级认知系统,这表明其他感觉和认知区域产生的刺激反应与枕叶和额叶皮层相似。随之而来的问题是:如何将成对的功能连接与全局功能整合进行整合?枕叶刺激选择性地增强了与背侧视觉通路分布的区域之间的功能连接,这表明枕叶刺激为视觉输入做好了整个大脑网络的准备。鉴于成对功能连接的广泛下降,结果发现额叶刺激并不影响全局整合,已经通过大脑的虚拟损伤建模预测了这种补偿作用,表明高度整合的节点对于大量单个连接的丢失更具弹性。总之,rTMS效应表现出变化的特征甚至是部分相反的特征,但是可以在不同的尺度上得到一致的解释。
最后基于局部抑制性和远程兴奋性连接的神经动力学,建立了定向信号的生成模型:preTMS的fMRI数据的频谱DCM分析揭示了枕叶、顶叶和额叶区域之间相互连接的密集网络;rTMS效应的建模表明刺激对枕叶和额叶区域的短程抑制和远程兴奋性信号传导产生不同的影响,以及直接或通过顶叶皮层增加对外侧前额叶皮层的兴奋性信号传导;额叶刺激使得传导至感知区域的各种反馈和前馈通路解偶联。Cocchi和Zalesky强调:在未来的个性化干预中,能够预测TMS的局部和分布式影响的计算模型可以削减经验测试的成本,有助于个性化TMS protocol。本文设计了一个可扩展的、跨比例模型,它可以预测特定目标皮层区域的扩散效应和调控方向。
关于TMS研究的解释和可比性,重要的是对多种刺激参数的使用。本文使用100%运动阈值的1-Hz刺激研究rTMS刺激后20分钟内的刺激效果,因此上述发现是在此参数组合下的特定结果,可能无法简单地概括得出其他抑制性或兴奋性刺激方法或不同的时间范围。尽管如此,很少有研究发现1-Hz和theta-burst rTMS在人类中具有可比的抑制作用,这表明theta-burst刺激也可能诱导整个皮质的异质反应。与1Hz刺激仅几个小时的持续时间相比,theta-burst刺激在几天内神经递质相关蛋白的表达升高。
虽然通常认为rTMS的延长效应与突触可塑性有关,但是仍需研究通过长时抑制或增强作用刺激对区域兴奋性的具体影响。目前广泛接受的是,TMS刺激之前和刺激过程中神经元兴奋的区域水平对效应的大小和方向有很大影响,不同的基线水平或激发被试具有不同的行为状态也会极大地影响刺激效应的幅度甚至方向。本文中在被试静息状态下也发现了刺激的空间异质性,可能与整个皮质的兴奋性状态有关,因此将来在不同的行为或大脑状态下比较相同的刺激方案也很重要。
总结:
总体而言,本文系统性地研究了rTMS的区域特异性,并解决了最近提出的有关TMS结果高度可变的四个主要问题:
(1)使用电场神经导航来识别每个人的功能性目标区域;
(2)使用fMRI研究刺激网络以外的调控效果;
(3)相比于假刺激,本研究包括一个对照区域来检测目标区域的功能特异性;
(4)将网络水平的宏观发现与生成模型结合,提出了与电磁刺激有关的细胞机制。
对认知网络的刺激扩散到整个大脑,认知hub之间紧密的联系可能会补偿局部影响并减弱刺激效应,因此有必要重复应用才能在高度整合的区域中获得长期效果。
原文:The physiological effects of noninvasive brain stimulation fundamentally differ across the human cortex
。

微信扫码或者长按选择识别关注思影
如对思影课程感兴趣也可微信号siyingyxf或18983979082咨询。觉得有帮助,给个转发,或许身边的朋友正需要。请直接点击下文文字即可浏览思影科技其他课程及数据处理服务,欢迎报名与咨询,目前全部课程均开放报名,报名后我们会第一时间联系,并保留名额。
更新通知:第十届脑影像机器学习班(已确定)