人类的大脑可以说是自然界中最复杂的系统之一。要了解它是如何运作的,必须了解神经活动和行为之间的联系。对该联系的实验研究需要在行为过程中使用工具与神经活动进行交互。然而,受到这些工具局限性的影响,人类神经科学已经达到严重瓶颈。虽然侵入性方法可以在行为过程中与大脑活动的高度特异性相互作用,但它们在人类神经科学中的适用性有限。尽管在过去几十年中得到了广泛的发展,但无创替代方案缺乏空间特异性,产生的结果通常充满了可变性和可复制性问题,并且对所涉及的神经机制的理解相对有限。在这里,我们全面回顾了与人类大脑活动相互作用的最新技术,并强调了当前的局限性和最近克服这些局限性的努力。除了电磁脑刺激的关键技术和科学进步之外,还引入了与人脑活动相互作用的新前沿,例如与任务无关的感觉刺激和局灶性超声刺激。最后,我们认为,随着非侵入性方法的技术进步和突破,向自适应闭环刺激的范式转变将是推进人类神经科学的关键一步。本文发表在Progress in Neurobiology杂志。(可添加微信号siyingyxf或18983979082获取原文,另思影提供免费文献下载服务,如需要也可添加此微信号入群,原文也会在群里发布)。思影曾做过多篇无创脑刺激相关文章解读,结合阅读,加深理解,感谢帮转支持(直接点击,即可浏览,加微信号siyingyxf或18983979082获取原文及补充材料):
经颅交流电刺激(tACS):使大脑节律同步以提高认知能力
经颅电刺激促进睡眠振荡及其功能耦合增强轻度认知障碍患者的记忆巩固
Trends in Neurosciences:通过脑振荡的夹带调节人类记忆
经颅磁刺激治疗老年抑郁症
相位相关TMS对脑电皮层运动网络的影响
Biological Psychiatry:解析电休克疗法的网络机制
前庭电刺激(GVS)的数据分析及在神经康复中的应用
通过脑电图/脑磁图观察到的大脑活动来指导经颅脑刺激
Trends in Neurosciences:基于信息的无创经颅脑刺激方法
从组水平到个体水平的精神分裂症谱系障碍无创脑刺激
PNAS:大脑区域间耦合的增加和减少会相应增加和减少人类大脑中的振荡活动 Theta-burst经颅磁刺激治疗创伤后应激障碍
亚属连接预测经颅磁刺激位点抗抑郁疗效
睡眠、无创脑刺激和老化的大脑研究
Nature Medicine:经颅交流电刺激可以改善强迫症
The Neuroscientist:整合TMS、EEG和MRI——研究大脑连接性
皮质成对关联刺激决策反应抑制:皮质-皮质间和皮质-皮质下网络
我们是如何感知行动的影响的?—关于中介感的任务态fMRI研究
TMS-EEG研究:大脑反应为卒中后的运动恢复提供个体化数据
皮质运动兴奋性不受中央区mu节律相位的调节
TMS–EEG联合分析在人类大脑皮层连接组探索中的贡献
人类连接体的个体化扰动揭示了与认知相关的可复现的网络动态生物标记物
重复经颅磁刺激产生抗抑郁效果的基础:全脑功能连接与与局部兴奋度变化
实时EEG触发的TMS对抑郁症患者左背外侧前额叶皮层进行脑振荡同步刺激
Nature子刊:卒中的可塑性调控:一种新的神经功能恢复模型
对PTSD和MDD共病患者的TMS临床治疗反应的脑网络机制的探索
创伤后应激障碍(PTSD)的功能连接神经生物标记
MDD患者rTMS治疗与亚属扣带回(SGC)亢进的关系
AJP:经颅磁结合脑网络研究:精神分裂症的小脑-前额叶网络连接
Biological Psychiatry: 经颅磁刺激前额皮层增强人类恐惧记忆的消退
JAMA Psychiatry:经颅直流电刺激背外侧前额叶减少特质焦虑对威胁刺激的反应
NEJM:Waving Hello to Noninvasive
Deep-Brain Stimulation
Biological Psychiatry: 利用脑成像改善经颅磁刺激治
θ短阵快速脉冲刺激治疗青年抑郁症的神经机制
1.引言
科学方法的一个基本组成部分建立在有目的和有针对性的实验变量修改和结果测量的基础上,以测试不同的假设。在研究大脑的运作时,各种细胞类型、神经群体、大脑区域和网络的活动是最重要的变量。为了稳健地调节这种活动,脑刺激工具必须以精确和有效的方式进行,而现有方式尚无法达到要求。虽然可以使用植入式装置进行大脑活动的直接调节,但植入的相关风险限制了人类神经科学的广泛应用。因此,我们将这项工作集中在非侵入性脑刺激(non-invasive brain stimulation, NIBS)上,并讨论了新的协议,特别是适应性闭环或脑状态依赖性刺激以及新的刺激方法如何有助于打破与人脑相互作用的界限。
空间和机制特异性(图1a;表1)是指刺激对神经活动的影响在多大程度上被限制在感兴趣的特定大脑区域,并且可以追溯到特定的细胞或分子机制。清楚地了解不同脑刺激背后的机制是正确解释实验结果的关键先决条件。目前,NIBS工具的空间特异性有限。例如,经颅磁刺激(transcranial
magnetic stimulation, TMS)在远离目标神经结构的地方传递,并且引发的场的大小作为刺激器和大脑之间距离的立方函数而下降。同样,经脊柱刺激必须在到达神经靶标之前穿过皮肤和脊柱。在电刺激的情况下,大部分施加的电流通过皮肤分流,到达皮层的电流扩散到宽阔的皮质区域。因此对于NIBS方法,高空间特异性是一个特别具有挑战性的要求(图2)。虽然侵入性方法可以实现高焦点性(例如,通过在感兴趣的区域直接植入刺激电极),但无创方法仅从头部外部施加影响,需通过头皮和头骨。考虑到人脑的神经密度,即使是集中在单个立方毫米脑体积上的刺激也会影响数以万计的神经元,这使得在不简化模型的情况下解释刺激结果成为一项艰巨的任务。低空间特异性意味着低机制特异性,因为非目标区域与目标区域共同被刺激。这使得很难使用NIBS作为调查因果关系的工具。此外,由于刺激伪影污染了大脑活动的同时记录,因此很难验证目标区域是否参与相关过程。NIBS还引起混杂的外周效应,如皮肤刺激和/或听觉伪影。在从实验结果中得出任何结论之前,必须将这些影响最小化或至少得到控制。在神经活动如何在每个空间尺度上受到影响的背景下,我们还提到机械特异性。在单个神经元的水平上,电刺激的影响是由化学和电机制介导的,并且被证明对特定细胞类型具有选择性。在大规模回路的水平上,刺激效应被证明是由共振、夹带和建设性或破坏性干扰介导的。
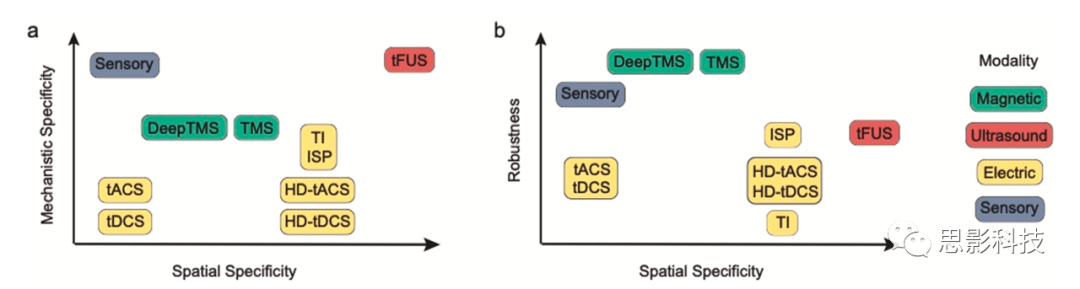
图 1. 基于空间特异性、机理特异性(a)和鲁棒性(b)的非侵入性脑刺激方法的比较。关于每种范式的放置的简要理由,见表1。

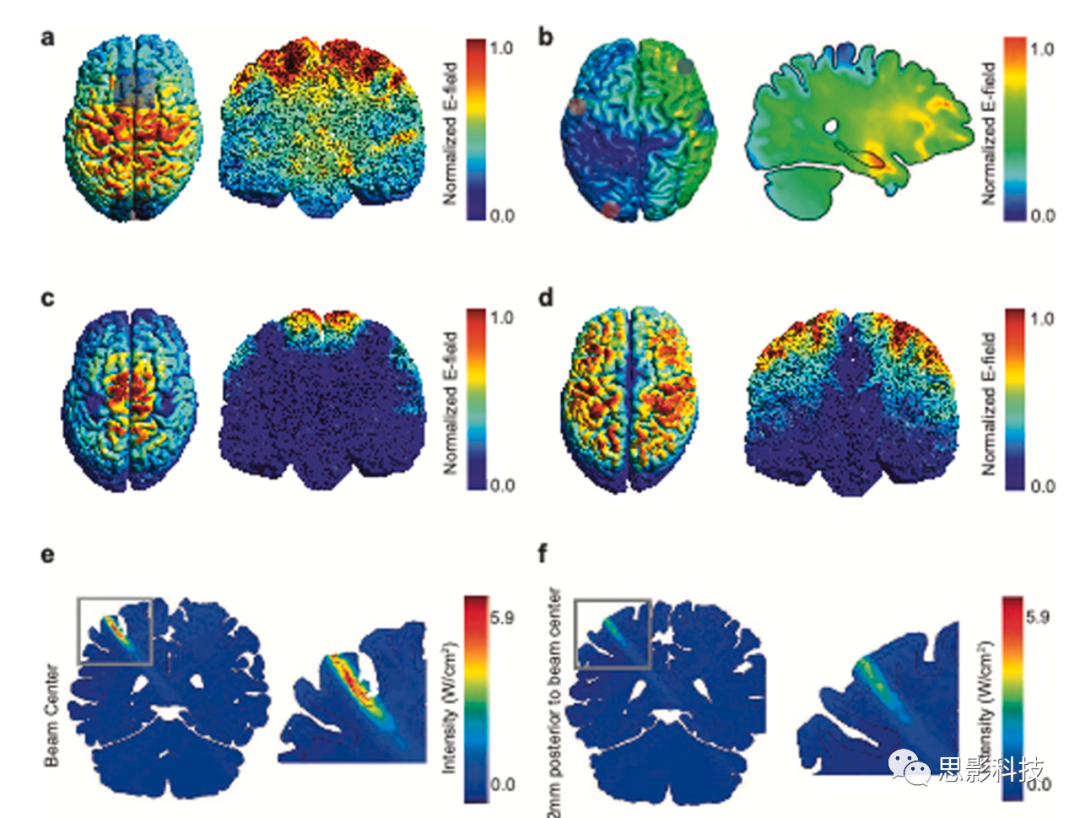
图 2. 无创脑刺激方法的空间特异性。
仿真显示大脑中电场的空间分布由(a)传统的经颅电刺激(transcranial electric stimulation, tES)、(b)靶向海马体的时间干扰刺激(temporal interference stimulation, TIS)(颜色表示每个位置电场的振幅调制程度)、c)使用8字形线圈的传统TMS,以及(d)使用H1线圈的深部TMS引起。
面板a,b和d是使用simNIBS计算的。电刺激电极的大致位置由深色斑块表示。图e和f显示了靶向人类初级躯体感觉皮层的经颅聚焦超声刺激(transcranial focused ultrasound stimulation, tFUS)的模拟声强场。
时间特异性是指刺激或刺激信号时间的精度。已知NIBS效应是大脑状态依赖性的,因此刺激方案应以最大化预期效果的方式靶向大脑状态。介导NIBS效应的大脑状态的动力学可以在不同的时间尺度上发生,例如毫秒或小时。如何在快速时间尺度下确保时间特异性,这取决于神经元效应相对于刺激信号或刺激的延迟和扰动。电磁脑刺激方案以可忽略不计的延迟影响神经元膜电位,因此在快速时间尺度方面,可能提供最高的时间特异性。相反,感觉刺激方案涉及神经元传导延迟,这取决于参与者的模式和生理状态。例如,躯体感觉刺激诱导早期(<40 ms)和晚期(>120 ms)皮质反应,这些反应强烈依赖于生理参数,包括血压或药物状态。同样,视觉刺激在30-300毫秒后影响皮质活动,这种潜伏期取决于参与者的年龄或刺激的亮度等因素。因此,与电磁刺激相比,由感觉刺激引起的神经元效应的确切时间远不如电磁刺激可靠。其他基于超声波的非侵入性脑刺激方法依赖于热或动力学机制。因此,它们可能表现出比感觉刺激更高的时间特异性,但低于电磁刺激。
阈值和阈下效应是指相对于目标神经元群体的激发阈值的刺激强度。超阈值效应是由足够强以产生动作电位的刺激引起的。亚阈值效应是由影响神经元放电概率而不直接引起动作电位的刺激引起的,例如通过神经元膜电位的转移,例如由于离子通道通透性的改变。
适应性是指刺激方案对个体大脑结构、功能状态或活动的定制。适应性可分为两类:静态适应性和动态适应性(图3)。静态适应性是指根据刺激前进行的测量(例如,单个峰值频率)离线调整或自定义刺激参数以适应每个研究参与者的大脑解剖和/或大脑活动的个体特征的能力。相比之下,动态适应性表示基于刺激期间提取的持续大脑活动的测量值在线调整刺激参数。动态适应性可以是间歇性的(例如,在脑状态依赖性刺激中),也可以是连续的(例如,在闭环刺激中)。对于无创刺激方法,连续动态适应性尤其具有挑战性,因为它们通常会产生较大的信号伪影,通常会阻碍在同一模态下同时进行测量和刺激。
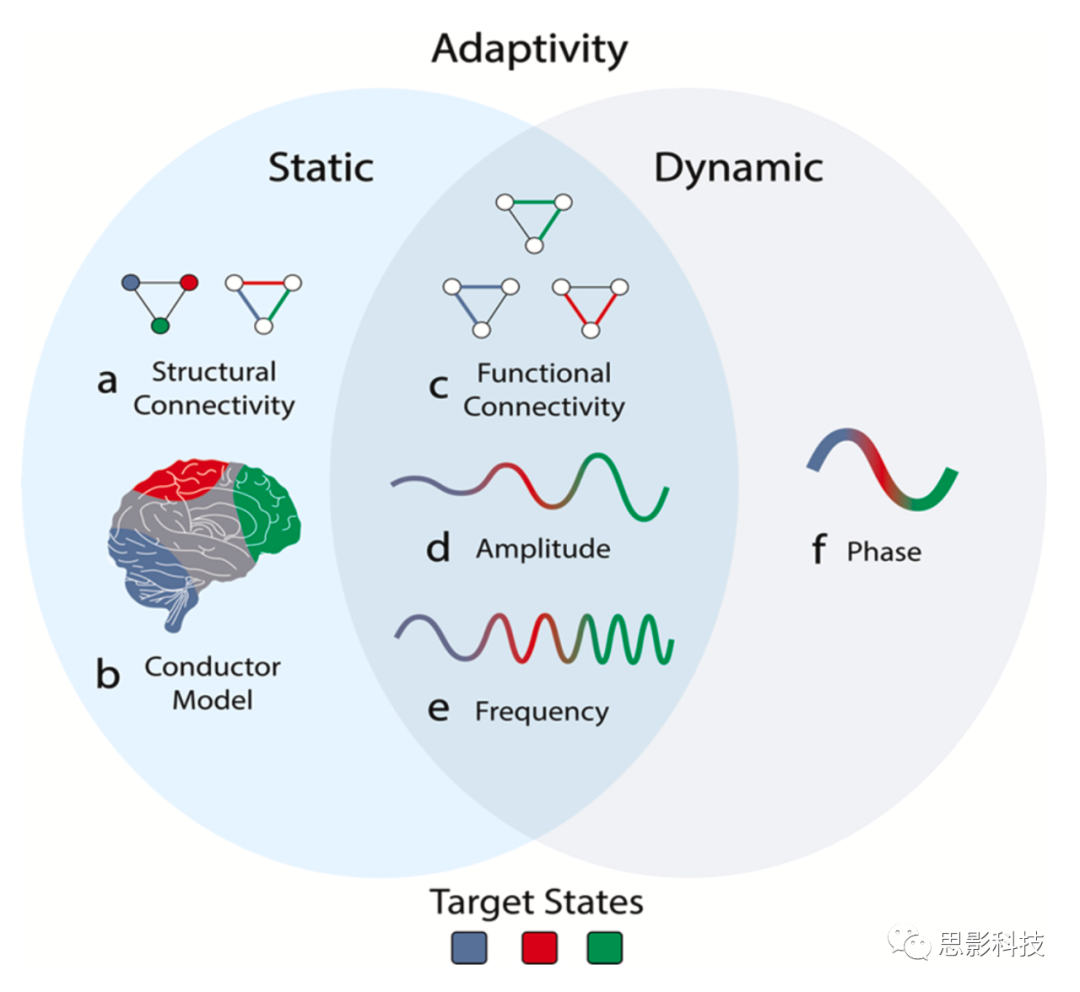
图 3. 无创脑刺激的静态和动态适应性
静态适应性是指靶向大脑静态状态的刺激。这些可以是结构网络(a)中的节点或边,也可以是导体模型(b)中的区域。当刺激目标动态变化状态时,例如振荡阶段(f),就会产生动态适应性。某些特征可以以静态或动态方式进行定位,例如功能连通性(c)、振幅(d)或频率(e)。
总体而言,脑刺激方法的稳健性可以定义为其对神经活动和功能/行为结果的影响的可靠性和可复制性(图1b;表 1)。然而,目前的NIBS技术表现出高度的个体间和个体内变异性、小效应量,并且报告的效应往往缺乏可复制性。这种鲁棒性缺乏可能是特异性和适应性较弱的结果。在下文中,我们将概述已建立的 NIBS 工具,并详细说明其稳健性和特异性。然后,我们概述了最近的技术进步,并介绍了NIBS领域最有前途的新方法。最后,我们确定了向前迈进的最关键的下一步。
2. 已建立的无创脑刺激工具及其界限
2.1. 经颅磁刺激 (Transcranial magnetic stimulation, TMS)
TMS是一种无创脑刺激方法,其中短的大电流脉冲被驱动到由高导电线制成的磁线圈中。每个电流脉冲的长度通常约为100-200 μs,并在线圈附近感应出强磁场(高达2特斯拉)。时变磁场(可以是单相或双相)穿透头皮和颅骨,进而在大脑中诱导电场,可以引发或调节神经活动。与经颅电刺激(transcranial electric stimulation, tES)的相对较弱的影响相反,TMS可以在皮层中诱导>100 V/m的电场。因此,根据脉冲强度,TMS也可以诱导动作电位,然后称为超阈值神经刺激。当直接TMS效应保持在阈值电位以下时,这种应用被称为亚阈值神经调节。
单个TMS脉冲对神经活动影响的基本机制可以追溯到TMS诱导的电场与神经组织的相互作用。在神经组织中诱导的电场直接改变组织中神经元的膜电位。这种变化主要是由沿神经元(例如轴突)纵向的电场的空间梯度驱动的,并表明直接的神经调制或刺激强烈依赖于线圈方向,并且该变化在感应电场强度变化最大的位置或者神经元方向改变的位置最大。
单脉冲TMS最初用于研究和绘制运动域,因为以高于运动皮层运动阈值的强度施加的刺激脉冲可以诱导通过运动诱发电位(motor-evoked potentials, MEP)测量的肌肉收缩。重复的TMS(repetitive TMS, rTMS)方案中TMS的多个(通常是亚阈值)脉冲连续应用较长时间(通常为几分钟),可以诱导持续刺激并触发神经可塑性的影响。近年来,已用rTMS作为精神疾病的治疗选择,例如治疗抵抗性抑郁症或强迫症(obsessive-compulsive disorder, OCD)。虽然rTMS背后的可塑性诱导机制尚未完全了解,但有证据支持与N-甲基-D-天冬氨酸(N-Methyl-D-aspartate, NMDA)介导的长时程增强(long-term potentiation, LTP)和长时程抑制(long-term depression, LTD)类似的机制,在动物模型中使用电刺激时观察到。高频刺激脉冲的长序列可以触发突触连接强度的增加,而低频脉冲的序列可能导致突触连接的长期减弱(LTD)。间歇性θ-爆破刺激(Intermittent theta-burst stimulation, iTBS)和连续θ-爆刺激(continuous theta-burst stimulation, cTBS)是旨在模仿LTP和LTD相关活动模式的rTMS方案,并且被证明具有类似的促进和抑制作用,这些作用被NDMA拮抗剂的应用所阻断。
除了TMS对神经组织的直接影响外,TMS脉冲总是伴随着响亮的咔嗒声(高达120 dB),这是由于脉冲产生过程中感应的电磁力引起的线圈绕组的快速膨胀。这些噪声导致与磁刺激脉冲同步的听觉刺激,使得难以进行盲法研究。TMS脉冲引起的皮肤神经和面部肌肉的激活是另一个必须考虑和解决的潜在混杂因素。假刺激TMS通常用作控制这些混杂的实验条件,通过倾斜线圈以减少神经激发,同时保留听觉伪影,或者利用具有磁性屏蔽的假刺激TMS线圈来减少大脑中的诱导场,同时再次保持咔嗒声并使用表面电极来模仿刺激引起的皮肤神经和肌肉激活。然而,这些方法在消除不需要的神经激活方面并不完全有效,并且在盲法研究的设计中仍然是一个挑战,因为线圈方向必须改变,或者线圈必须在不同的实验条件之间完全交换。
在靶向局限性皮质区域时,一直在努力提高TMS的空间特异性。通过使用某些类型的线圈(例如,8字型线圈),TMS可以产生相对较高的空间分辨率(图2c),可以在皮质区域引发更具选择性的反应,例如,与单个手指相关的反应。虽然由于TMS脉冲引起的超阈值激活区域可能相对较小并且限制在线圈的焦点区域,但亚阈值调制仍然可以在感应场较弱的更大区域中观察到。在解释TMS结果时必须考虑这种局限性,因为最近的结果表明,即使在低强度水平下,TMS也可以产生显著影响。例如,亚阈值TMS可以影响短间隔皮质内抑制(short-interval intracortical inhibition, SICI),即强度低至静息运动阈值60%的调节脉冲可以可靠地调节随后的超阈值运动诱发电位幅度。由于TMS的聚焦率随着深度的降低而迅速降低,TMS只能以空间特异性显著降低为代价到达深度靶点。此外,TMS诱导的电场总是在线圈附近最强,使得任何线圈配置在物理上都不可能感应出同时聚焦和深的电场。深度TMS可以使用一类TMS线圈进行,称为H线圈,其设计用于最小化感应电场与深度的衰减率,使其能够到达深部大脑区域(图2d),同时仅在浅表区域诱导稍微强的电场。尽管使用H线圈到达深部大脑区域的能力是以空间特异性显著降低为代价的,但最近的研究表明,基于H线圈的TMS可能有益于治疗抑郁症或强迫症(obsessive-compulsive disorder, OCD)。
尽管TMS取得了许多成功,并对实验和临床神经科学产生了巨大影响,但TMS结果仍存在显著的可变性和可重复性问题。使用单脉冲和成对脉冲TMS协议进行的皮质兴奋性测量在个体之间差异很大。在rTMS的促进作用和抑制作用中也观察到类似的变异性问题。虽然最近的研究表明,这种变异性可能是由于样本量小、TMS以开环的方式应用(与正在进行的大脑状态无关),或者目标区域连通性分布的变化可能导致TMS结果的个体变异性。需要更多的研究来阐明这种变异性背后的具体机制,并开发规避它的方法。
总体而言,TMS的空间特异性有限,取决于颅内场强度。更强的脉冲振幅会诱发更大的电场,可能使非目标区域激活。尽管深部TMS能够使用专门设计的线圈在更深的大脑区域诱导更强的场(图2d),但其空间特异性因此而降低。事实上,深层TMS招募了分布在整个皮层的大脑区域,使得很难将由此产生的效应归因于特定的目标区域。这降低了深度TMS的机制特异性(图1a)。最后,虽然超阈值TMS的效果是NIBS领域中最强大的(图1b),但其机制特异性受到躯体感觉和听觉刺激的阻碍。虽然假线圈的使用是感觉刺激的适当控制,但重要的是要确保参与者不清楚他们接受的刺激方案。此外,感觉大脑区域激活阻碍了因果关系对目标区域的明确归因。因此,为了获得高机械特异性,设计一种与感觉共刺激无关的TMS装置是非常有必要的。
如您对脑电等数据处理如脑功能,脑网络或其他模态脑影像数据处理感兴趣,请浏览思影以下链接(直接点击即可浏览),感谢转发支持。(可添加微信号siyingyxf或18983979082咨询):
北京:
第三十九届脑电数据处理中级班(北京,10.11-16)
更新:第十三届眼动数据处理班(北京,10.26-31)
上海:
第二十五届近红外脑功能数据处理班(上海,10.17-22)
重庆:
第四届脑电机器学习数据处理班(Matlab版本,重庆,9.24-29)
数据处理业务介绍:
思影科技EEG/ERP数据处理业务
思影科技近红外脑功能数据处理服务
思影科技脑电机器学习数据处理业务
思影数据处理服务六:脑磁图(MEG)数据处理
招聘及产品:
思影科技招聘数据处理工程师 (上海,北京,南京)BIOSEMI脑电系统介绍
2.2. 经颅电刺激 (Transcranial electrical stimulation, tES)
弱电流(<2毫安)在头皮上的应用已成为人类神经科学研究中广泛采用的非侵入性神经调节方法。tES主要参数包括电极蒙太奇、刺激强度和施加波形。最成熟的波形包括直流(direct current, DC)、随机噪声(random noise, RN)和交流电(alternating current, AC)刺激。
这些方法中最早的是经颅直流电刺激(transcranial direct current stimulation, tDCS),可以根据附近电极的极性来操纵皮质兴奋性。研究表明,阳极刺激可以去极化,而阴极刺激可以超极化静息膜电位。此外,tDCS的作用是由不完全描绘的突触机制介导的,导致长期可塑性。例如,运动皮层中γ-氨基丁酸(gamma-aminobutyric acid, GABA)和谷氨酸浓度的变化预测了运动学习对tDCS的反应的变化。tDCS的一些影响,例如运动皮层兴奋性的改变,可以通过经颅随机噪声刺激(transcranial random noise stimulation, tRNS)来实现。然而,效果可以通过不同的机制来传达。虽然tDCS的影响被认为是由膜电位的变化引起的,但tRNS的影响归因于钠通道的重复打开。通过实验证实,研究表明tRNS的影响随着钠通道阻滞而改变。互补的是,tRNS对视觉感知的影响被证明是由随机共振介导的,即通过添加亚阈值噪声来增强神经信号处理。一般来说,tDCS和tRNS效应的机制是多方面的和异质的,既锚定在膜电位的动态变化中,也锚定在突触水平的塑性效应中。
近年来,经颅交流电刺激(transcranial alternating current stimulation, tACS)在研究非侵入性人脑活动振荡的因果作用方面发挥了核心作用。与tDCS和tRNS相比,tACS的影响可以直接与大脑振荡活动相关联。传统上,主要的作用机制归因于夹带和共振。夹带是指内源性脑活动与外部施加的电流的相位锁定,而共振是指当靶向其固有频率时内源性活动幅度的增加。许多动物模型研究已经证实,这些基本原理确实在观察到的tACS效应中起着重要作用。例如,在麻醉雪貂中,表明tACS通过共振效应调节大规模皮质网络活动。此外,对非人灵长类动物的几项研究现在已经证实,tACS导致神经元尖峰时间与外部施加的电场的相位对齐,作为夹带的令人信服的证据。在人类研究中,通过tACS获得神经元夹带的证据是,研究表明:感觉感知取决于施加到初级感觉区域的电场的相位。最近,描述了tACS影响大脑生理学的另一种机制,即建设性和破坏性干扰,导致相依赖性增强和抑制正在进行的振荡。使用刺激伪影源分离(stimulation artifact source separation, SASS)能够在tES期间重建大脑活动,表明根据刺激信号和目标脑区振荡之间的相对相位角,诱发的大脑反应的大小可以分别增加或减少11.7±5.14%和10.1±4.07%。
tACS还可用于有针对性地调制大规模网络连接。这种范式被证明有助于研究大规模同步在认知过程(如感知和工作记忆)中的因果作用。通常,双位点蒙太奇通常用于定位两个皮质区域之间的功能连接,其中两个单独的电场以0或180度的相位差施加。人们反复发现,0度相位差增强了同步性,而180度相位差会损害同步性。然而,目前尚不清楚这种影响是否具有动态本质,或该影响是否为神经可塑性过程的结果,因为它们可能仅在长时间的刺激后表现出来。此外,应该注意的是,使用共同返回电极可能会使两个刺激部位的相对相位与电场的空间分布混淆。当使用共同返回电极时,0度相位条件下电场的空间模式与180度相位条件下的电场不同。
一般来说,关于tACS基本机制的许多问题仍未解决。批评者指出,由于中间组织对大部分施加电流的衰减(≈75%),导致颅内电场强度低(<0.5 V/m)。根据在大鼠中获得的记录,这种场强被认为不足以影响神经元的尖峰时间。然而,有研究发现弱几个数量级的电场可以调节神经元活动(取决于细胞类型)。这与上述在非人灵长类动物中的实验结果一致,结果表明tACS可以夹带单细胞的峰值时间。最近,研究表明,tACS可以选择性地夹带快速峰值抑制性中间神经元的尖峰时间。tACS诱导的电场强度通常略低于内源性低频活动,如θ(<1 V / m),但发现它们对网络活动的影响是可比的。体外研究表明,内源性电场通过反馈机制引导新皮质网络活动,使得在进行活动的同相中应用相当大小的外部场会增加同步放电,而具有持续活动的异相场的应用会减少同步放电。其他体外研究也揭示了类似的现象,即外部施加的电场低至 0.2 V/m 的效应会夹带神经元尖峰时间,最好是在相对于正在进行的振荡的某些相位。这种机制可以解释tACS对诱发大脑电位幅度的相位依赖性和相关感知的调节作用。这些发现强烈表明,通过使用闭环方法可以增强tACS的神经调节作用及其稳健性。然而,在考虑在活体动物中进行的研究时,必须强调的是,tACS通过多种感觉通路影响神经元活动。一系列实验表明,通过在电极下方的皮肤上应用局部麻醉剂,可以大大减轻tACS对运动系统的影响。这意味着躯体感觉刺激可能是tACS的潜在重要机制。此外,电流扩散到视网膜被证明可以夹带视觉系统中的活动。
tES效应的一个主要中介是电场的空间范围,通常使用合适的大脑导体模型来估计。这些模型为tES的空间特异性和鲁棒性提供了一些见解。同时使用两个大tES电极(> 25 cm2)可以最大化电场强度和深度,影响大脑的广泛区域。高密度tES(high-definition tES, HD-tES)对此进行了改进,通常使用小型电极(<2厘米)的排列使得四个非目标电极围绕着一个目标电极。HD-tES排布可以比传统的tES实现更高的空间特异性,但代价是电场强度和深度。使用任意数量的电极和目标大脑的导体模型,可以优化施加到每个电极上的电流,以最大化特定位置的焦点和深度。令人惊讶的是,适当优化的tES场甚至可能通过利用脑脊液的电流路径来调节大脑深处区域。
识别tES作用机制的一种方法是使用同步神经成像,例如脑电图(electroencephalography, EEG)、脑磁图(magnetoencephalography, MEG)或功能磁共振成像(functional magnet resonance imaging, fMRI),以评估在线刺激对脑生理学的影响。为了实现这种方法,必须小心地将刺激伪影与生理信号分开。成功证明这种范式应用的第一批研究使用了tDCS和MEG以及后来的tDCS和EEG。除了确定tDCS效应的潜在机制外,该范式在研究特定生理特征对大脑功能和行为的因果作用方面也非常强大,例如,在听觉或视觉领域。由于与tDCS相关的伪影主要由宽带噪声组成,因此与在整个频谱中引入非线性伪影的tACS相比,抑制此类伪影的挑战性较小。通过引入一种新的刺激方案,该方案使用高频载波信号,该信号在特定目标频率(称为幅度调制的tACS,amplitude-modulated tACS,AM-tACS)下在其幅度上进行调制,可以减少感兴趣的生理频段的伪影污染。将MEG与合成孔径磁力测量(synthetic aperture magnetometry, SAM)结合使用,这种新的刺激方案允许在AC刺激期间成功重建生理反应。后来,AM-tACS期间的生理反应也可以使用刺激伪影源分离(stimulation artifact source separation, SASS)从EEG信号中成功恢复,为闭环tES提供技术先决条件。
在不断努力更好地了解潜在机制的同时,tES正在成为治疗精神和神经系统疾病的重要临床工具,最近在没有临床诊断的健康受试者中工作记忆或强迫行为改善方面有希望的结果。在这两项研究中,发现靶向目标认知功能背后的个体振荡脑网络的内在频率对干预的成功至关重要。虽然两项研究的目标组均由健康受试者组成,但结果表明,类似的方法可能对表现为工作记忆或强迫行为异常的临床人群有益。
总体而言,tES 用大电极(> 25 cm2)诱导一个宽电场,可以渗透整个皮质叶,因此由于非目标区域的募集而表现出较低的空间和机制特异性(图1a)。虽然HD-tES提供比传统tES更高的空间特异性,但诱导电场更弱,更浅。因此,HD-tES中更高的空间特异性是以牺牲鲁棒性为代价的(图1b)。与tES相关的主要问题之一是躯体感觉和视觉区域的感觉共刺激,阻碍了其机制特异性。虽然tES允许以tACS的形式进行频率特异性神经调节,并以tDCS的形式靶向调节皮质兴奋性,但感觉共刺激和弱颅内电场强度需要设计更稳健和机理特异性的NIBS方法。
2.3. 神经反馈
基于目标活动的连续感觉反馈的大脑活动的自我调节已成为神经调节中另一种广泛应用的方法。神经反馈的一个关键机制是操作性或工具性调节,其中神经元活动的意志调节通过奖励得到加强。神经反馈被证明会导致靶向神经活动的特定和持续变化,例如,通过EEG、MEG或fMRI评估,在训练后数小时至数月的时间尺度上发生变化。还表明,涉及额顶和扣带-眼部区域的认知控制网络在大脑活动的自我调节期间是活跃的,并且由于反馈,前岛叶和基底神经节参与奖励处理。然而,尽管有明确的生理效应,但缺乏强有力的临床效应证据。此外,观察到的临床效应对目标区域活动反馈的特异性仍存在争议。
总体而言,虽然神经反馈可以利用具有高度空间特异性的神经影像学模式,例如fMRI,但通常不适合建立目标区域对观察到的实验效果的因果贡献,因为非目标区域必然有助于目标区域活性的变化。此外,神经反馈效应背后的机制仍然很大程度上是未知的,这使得关于神经反馈的机制特异性的陈述变得非常困难。
3. 近期的发展
3.1. 特异性
最近,引入了时间干扰(temporal interference, TI)电刺激,这是一种基于先前应用的干扰电流刺激的刺激范式,例如,在疼痛管理中(当时称为干扰电流疗法,interferential current therapy,ICT或IFC)。在TI电刺激中,施加两个具有高但略有不同的频率(例如,2和2.01 kHz)的正弦刺激载流子电流。电流产生高频电场,该电场在差分频率(例如,10 Hz)处进行幅度调制。组合场在两个场具有相似幅度的位置表现出最大幅度调制,而在其他任何地方(例如,在每个电极附近)的幅度调制很小。由于神经组织的非线性特性,它被认为仅响应电场的幅度调制包络,而忽略了高频载波。这可能使TI电刺激比传统的tES具有更高的空间特异性,并且能够选择性地靶向刺激大脑深处区域(图2a,b)。在小鼠中进行的初始体内实验表明,高强度TI电刺激可以唤起运动皮层中的可控活动,并选择性地靶向海马体,而不会刺激上覆的皮质区域。然而,直到现在,TI电刺激还不能成功地转化为人类研究。体外研究表明,TI电刺激需要比传统tACS高得多的电流水平来诱导相同的海马伽马振荡调制。还表明,即使没有幅度调制,TI电刺激中使用的高频载波信号也可以在神经组织中产生复杂的效应,例如传导阻滞或强直放电。虽然与传统的tACS相比,TI电刺激具有增加空间特异性和深度选择性的潜力,但需要更多的研究来理解和解决其缺陷,并在人类中成功应用这种刺激方法。使用磁场进行TI刺激(magnetic fields for TI stimulation, TIMS)可以克服这些陷阱,但在技术上非常具有挑战性,例如,由于磁场的必要大小和线圈中相关的热量。
最近提出的另一个试图解决传统tES缺点的范式是交叉短脉冲(intersectional short-pulse, ISP)刺激。在这种范式中,在头皮上放置多个电极,并通过不同的电极按顺序注入短的高强度电流脉冲。由于神经元膜具有缓慢的时间常数,因此它们集成了在不同脉冲期间传递的刺激电流,并且组合电场最强的位置受到最大刺激。虽然这可能导致比传统的双位点tES更高的空间特异性,但研究表明,ISP刺激的空间特异性与高清tES(high-definition tES, HD-tES)的空间特异性相当,HD-tES是一种更传统的方案,使用多个电极对进行优化放置。在这里,更高的焦点是通过电场的空间求和实现的而不是时间求和。然而,由于ISP刺激使用短电流脉冲而不是连续电流,因此与其他tES协议相比,主要优点与头皮感觉降低有关。这提高了该方法的机制特异性,因为减轻了皮肤刺激的潜在混杂。此外,由于总刺激电流在多个电极之间均匀分配,ISP刺激范式可以提供比传统tES更高的电流,同时保持通过每个电极的电流水平与tES相同。这为ISP刺激提供了更高的鲁棒性,因为刺激诱导的总电场可以增加到更可靠地调节神经活动的水平。虽然已经表明ISP刺激可以调节人类的α活性,但需要更多的研究来研究这种范式的其他应用。
经颅聚焦超声刺激(Transcranial focused ultrasound stimulation, tFUS)是一种新兴的无创脑刺激范式,具有比任何其他无创刺激方法更高的空间特异性的潜力(图2e,f)。在tFUS中,频率为250-1000 kHz,空间峰值时间平均强度为3-30 W/cm2的超声波通过放置在头皮上的传感器传递。超声波可以聚焦在感兴趣的大脑区域,空间分辨率为几毫米,并且具有任意深度。超声波通常以短脉冲(1 毫秒)或一次连续数百毫秒。2010年的一项开创性研究表明,应用于小鼠的tFUS可以引发足以唤起运动行为的神经活动,并在海马体中诱导河豚毒素(tetrodotoxin, TTX)敏感的神经活动。最近对人类参与者进行的研究表明,tFUS可以调节初级躯体感觉皮层中的神经活动,应用于初级运动皮层时可以抑制TMS诱发的MEP幅度。还表明,tFUS可能具有临床相关性,例如,在改善阿尔茨海默病患者的神经心理学评分方面。tFUS对神经组织的影响可能是由于机械力(称为声辐射力;acoustic radiation force,ARF)影响渗透组织。通常假设ARF可以与神经元膜中的机械敏感离子通道相互作用,从而影响神经活动。在常见的tFUS参数下,热效应通常被认为不太可能。最近在小鼠和豚鼠中的研究表明,tFUS可以引发显著的听觉激活,这种激活在动物耳聋时被消除,即使刺激施加到不相关的大脑区域。最近的另一项研究表明,人类参与者可以可靠地区分应用于视觉皮层和假试验的tFUS,并报告在刺激试验期间听到高音调。当刺激引起的声音被掩蔽音调掩盖时,辨别性能下降到偶然水平。虽然其他研究表明,tFUS对神经活动的影响不仅仅是听觉刺激,但这些研究还强调,听觉刺激是tFUS的一个显著混淆,必须在研究设计中考虑。
使用人工手段有目的地调节大脑活动的另一种方法是受控的感觉刺激。采用这种范式,可以通过有效和自然的机制改变正在进行的大脑活动。研究表明,感觉刺激可通过跨模态相位重置来调节与一般认知功能相关的大脑活动,例如,通过听觉音调重置节律性视觉感知。这种相位重置被发现低于超模态注意控制。此外,已经证明,感觉刺激对认知功能的影响也可以由网络共振介导,例如,当使用频率靶向听觉刺激时,额顶α-β同步的增强与改善工作记忆性能有关。最近,人们发现,在持续α振荡的特定阶段提供视觉刺激可以通过重新激活其内容来改善工作记忆性能。在睡眠期间,在持续缓慢振荡的特定阶段提供的听觉刺激可以增强陈述性记忆的巩固。这些结果表明,自适应闭环感觉刺激可能成为神经调节的有效临床工具。最近的临床研究成功证实了这一观点。例如,当时间正确时,双峰听觉-躯体感觉刺激可能会使与耳鸣相关的脑节律不同步。一项双盲假对照临床研究发现,耳鸣改善可能与耳蜗核中的LTD有关。另一组临床研究表明,视听伽马刺激可以改善阿尔茨海默病小鼠模型中的tau蛋白病理学,从而改善认知功能。综上所述,这些结果表明,适应持续大脑活动的感觉刺激可能成为治疗各种神经和精神疾病的有力工具。
3.2. 适应性
静态适应性,即根据个体解剖学或生理特征离线调整或定制刺激参数(图3,左),旨在解决刺激效应中的异质性问题。这种异质性可能由结构变量以及参与者之间大脑活动的功能差异引起,这取决于年龄、基因表达或临床诊断等因素。研究表明,tACS对顶枕α振荡的个体间变异性的很大一部分可以通过个性化的电流模型来解释。虽然皮质区域的组织因参与者而异,但单个T1或T2加权结构MRI扫描可以与自动皮质包裹方案结合使用,以高精度定位皮质区域。这为基于个性化导体模型的靶向tES协议铺平了道路,可提供源和传感器之间电流流向的精确正向模型。然后,可以使用这些模型通过线性逆解从EEG/MEG记录中重建目标活动。此外,这些模型与多电极tACS蒙太奇中的电流加权有关,旨在优化外界皮质区域的最佳靶点。通过将模型预测与刺激期间记录的实际EEG/MEG数据进行比较,可以进一步提高这种方法的有效性。除了T1或T2加权结构MRI扫描外,弥散张量成像(diffusion tensor imaging, DTI)还可以为识别和表征结构脑网络添加重要信息。这种模型可以基于网络控制理论,该理论可用于识别使大脑网络特别容易受到刺激的节点。
除了使刺激适应解剖学特征外,还可以利用从血液动力学或电生理学测量中获得的功能性脑网络信息来减少刺激效应的异质性。例如,在抑郁症的治疗中,发现背外侧前额叶皮层(dorsolateral prefrontal cortex, DLPFC)和膝下前扣带皮层(anterior cingulate cortex, ACC)之间的功能性血流动力学连接预测了对rTMS的反应。相应地,最近表明,靶向DLPFC和ACC之间的fMRI连接的自适应rTMS协议可以导致更高的反应率。为了识别神经精神疾病中改变的大脑网络,基于任务的脑电图测量也显示出一些希望,例如,靶向与强迫行为相关的额叶奖励处理网络或与工作记忆功能相关的额颞叶网络。
从最近的神经调节研究中产生的一个关键原理表明,刺激的频率应该适应目标网络的振荡幅度和频率。模拟表明,只有当刺激频率与靶点内源性振荡的频率紧密匹配时,才能触发目标网络中的尖峰时间依赖性可塑性。
与静态适应性相反,动态适应性可以通过连续调整刺激参数以适应快速变化的大脑状态或其衍生物(例如实时连接测量)(图3,右)。许多研究表明,NIBS协议的影响很大程度上取决于正在进行的脑振荡阶段,该阶段被发现与神经元兴奋性的波动相关。例如,研究表明,在持续感觉运动节律(即8-12 Hz振荡)的EEG负相位使用200个三脉冲以100 Hz突发频率和∼1 Hz重复率传递TMS脉冲可以导致对运动诱发电位(motor-evoked potentials, MEPs)的LTP样效应。相比之下,提供靶向EEG正相位或开环的TMS脉冲对MEP没有影响。这种效应被认为是由α振荡幅度所反映的皮质兴奋性的节律性波动介导的。同样,研究表明,在睡眠期间持续缓慢振荡的高兴奋性(负)相位传递大脑状态依赖性听觉刺激可以改善陈述性记忆的巩固,而负相刺激对记忆没有影响。这得到了一项关于工作记忆的研究的补充,其中视觉冲动刺激导致工作记忆表征的加强,并在每个研究参与者特有的最佳相位刺激时改善了性能。
TMS类似,tES也可用于引发相位依赖性效应,尽管基本原理可能不同。体外研究可以证实,弱外部场(~0.2 V/m)对同步神经元尖峰的影响通过非线性方式将持续活动放大,因此在施加的电场和正在进行的相干神经活动之间的特定相位差下,同步尖峰得到增强。在系统层面,发现大规模功能性脑网络在其振荡幅度中表现出快速(50-100 ms)瞬态动力学,这些振幅在神经或精神疾病中发生了变化。这些特定时空活动模式的瞬时动力学可能被证明是脑状态依赖性刺激方案的有效靶点,这些刺激方案旨在调节认知脑功能或临床症状的严重程度。使用tES实现这种范式需要动态适应瞬态的当前位置、强度和极性。
综上所述,所提出的研究表明,使用闭环方法可以显著改善tACS,其中施加的电流被锁相到通过EEG或MEG测量的持续脑振荡。然而,这种范式的实施受到目标频率的刺激伪影的阻碍,这些刺激伪影比大脑活动大几个数量级。当靶向非常低频的振荡(例如睡眠期间的慢波)时,通过停止刺激几秒钟以获得无伪影的相位估计值,这个问题已经被规避了。然而,当靶向更高频率的振荡(如θ或α活性)时,不能假设相位在几秒钟内线性恒定。因此,可行的闭环锁相tACS技术的开发依赖于在刺激期间成功抑制目标频率的EEG/MEG信号伪影。目前,这只能通过AM-tACS实现。模拟表明,这种刺激波形表现出与传统tACS相同的靶点激活机制,但可能需要更高的刺激强度才能达到等效的效果。因此,使用SASS,AM-tACS是建立闭环tACS的最有前途的协议,提高了tES的鲁棒性和特异性。
4. 展望
NIBS的低空间分辨率(图2)仍然是与人脑相互作用的最大障碍之一。克服这一障碍将是使用NIBS推进人类神经科学的最关键步骤。虽然tFUS等新方法可以获得高空间分辨率(图2e,f),但对新方法和已建立的无创方法背后的细胞和分子机制的详细见解可以通过使用影响特定细胞类型的刺激参数来提高其有效的空间分辨率。新的刺激范式可以利用神经组织的非线性特性来改善空间特异性。这方面的一个例子可以在时间干扰电刺激(temporal interference, TI)中找到,该技术利用神经组织的非线性振幅解调能力,使用仅局部幅度调制的电场来提高空间分辨率(图2b)。同样的机制可以潜在地用于提高TMS的空间分辨率并实现深度特异性。然而,应该记住,刺激方法的空间分辨率增加可能会导致无法使用非侵入性测量(如EEG或MEG)检测神经元效应。
将毫秒级精确的NIBS协议锁定在目标区域正在进行的脑振荡相位,这也可能为提高空间分辨率铺平道路。这在tACS的情况下尤其重要,其中诱导电场广泛覆盖皮层的几个叶。同时的躯体感觉和视觉刺激增加了电流的空间传播,使得tACS可以假设调节广泛且功能不同的大脑网络。矛盾的是,弱电场对神经元同步的影响取决于施加场相对于持续活动的时间。基于这一发现,我们预测闭环tACS协议将利用时间特异性,通过将施加的场锁定到目标区域中的活动,从而导致空间特异性的增加。
推进非侵入性脑刺激的另一个障碍是无法控制目标网络中的长期可塑性。最近的研究表明,双位点tACS蒙太奇 - 目前最有希望选择性地影响神经元连接的技术 - 通过触发尖峰时间依赖性可塑性(spike-time dependent plasticity, STDP)来起作用。因此,提高触发STDP的NIBS方法的空间分辨率可以提高控制长期可塑性的能力。
NIBS协议对认知功能的影响主要取决于这些协议如何影响潜在的大规模大脑网络。因此,优化此类协议对于已知参与感兴趣大脑功能的大脑网络的自适应靶向至关重要。然而,该研究领域仍然是一个尚未开发的前沿领域。最近将tACS应用于涉及工作记忆的靶向额颞网络和参与强迫行为的眶额叶网络的研究已经证实了之前的动物研究的发现,表明网络共振是tACS效应的重要介质。这些共振频率因个体而异,并且发现未能靶向它们会在个体层面上消除生理和行为影响。
展望未来,量化单个网络动态以响应刺激也至关重要。为此,网络控制理论已应用于通过其结构连通性(加权邻接矩阵,例如,从DTI获得的白质束强度)定义的大规模网络。网络控制理论根据每个区域在任何给定时间点的激活强度来定义大脑状态,例如,fMRI血氧水平依赖性(blood-oxygen-level-dependent, BOLD)激活,其中一种大脑状态对先前状态的依赖性仅由结构连接矩阵和每个节点的输入介导。这定义了一个线性动力系统。然后,优化每个节点的控制输入以实现所需的动态。虽然这些模型已成功应用于侵入性电刺激,但无法有效地靶向NIBS的单个节点,同时记录其活动限制了此类建模方法的适用性。
更灵活的模型能够表征大规模振荡脑网络动力学。这些是基于神经质量(neural masses)(例如,Wilson-Cowan类型),或抽象振荡器(abstract oscillators,例如可以再现许多经验观察的Kuramoto模型)。通过使用这些方法,可以模拟大脑网络的复杂非线性动力学及其对局灶性刺激的反应。这些模型在理论上可以比网络控制理论的线性方法更紧密地描述大脑对刺激的反应的动力学。然而,它们并没有提供一个简单的解决方案来优化刺激参数,从而产生所需的大脑状态。此外,还表明,响应刺激的网络控制理论的预测由神经质量模型网络再现。
在机器学习(machine learning, ML)中可以找到通过非侵入性方法表征和控制非线性脑网络的普遍适用的数学框架。大脑活动的动力学可以在状态空间模型中捕获,模型学习连续时间点的状态之间的转换函数。此转换函数还可以依赖于控制输入。然后,可以优化控制输入(或从状态映射到控制输入的函数参数)以生成所需的状态序列或分布。这种方法广泛用于控制非线性动力系统的其他领域。在神经科学中,最近也可以对大规模大脑网络直流电刺激的动态反应进行建模,但尚未成功实施ML来控制NIBS。建立新型刺激协议的另一个有希望的前景建立在从人工脑网络(如卷积神经网络convolutional neural networks,CNN)推断刺激模式的基础上,如视觉神经假体的计算机显示的那样。在这里,大脑的视觉系统是使用深度学习(deep learning, DL)建模的。基于所得到的模型,推导出了预测更高级别视觉皮质反应的视神经刺激模式。
5. 结论
NIBS的最新进展,特别是闭环应用,开始转化为与人脑的更强大和特定的非侵入性相互作用。这些新方法不仅有可能彻底改变人类神经科学,而且还有可能为有效治疗各种神经和精神疾病铺平道路。为了使这种相互作用成为可能,自适应闭环刺激方法以及新的刺激范式和技术的发展开始解决现有NIBS方法的局限性。新的前沿领域,如tFUS和感官刺激是推动该领域前进的有希望的途径。闭环范式和计算机建模方法对于建立ML以自动调整刺激参数,从而提高鲁棒性和特异性至关重要。这可能是迈向与大脑活动进行更强大和多功能互动的关键一步,以推进人类神经科学。
6.总结:
本文回顾了当前的一些无创脑刺激技术,包括经颅磁刺激、经颅电刺激、神经反馈、经颅聚焦超声刺激等。从空间特异性、机制特异性、鲁棒性等方面比较了几种无创脑刺激技术,展望了未来无创脑刺激技术的发展方向,包括闭环刺激技术的应用、网络控制理论的应用、机器学习算法的应用等。这些新方法不仅有可能彻底改变人类神经科学,而且还有可能用于有效治疗各种神经和精神疾病。
如需原文及补充材料请添加思影科技微信:siyingyxf或18983979082获取,如对思影课程及服务感兴趣也可加此微信号咨询。另思影提供免费文献下载服务,如需要也可添加此微信号入群,原文也会在群里发布,如果我们的解读对您的研究有帮助,请给个转发支持以及右下角点击一下在看,是对思影科技的支持,感谢!

微信扫码或者长按选择识别关注思影
非常感谢转发支持与推荐
欢迎浏览思影的数据处理业务及课程介绍。(请直接点击下文文字即可浏览思影科技所有的课程,欢迎添加微信号siyingyxf或18983979082进行咨询,所有课程均开放报名,报名后我们会第一时间联系,并保留已报名学员名额):
脑电及红外、眼动:
北京:
第三十九届脑电数据处理中级班(北京,10.11-16)
更新:第十三届眼动数据处理班(北京,10.26-31)
上海:
第二十五届近红外脑功能数据处理班(上海,10.17-22)
重庆:
第四届脑电机器学习数据处理班(Matlab版本,重庆,9.24-29)
核磁:上海:
第六十九届磁共振脑影像基础班(上海,9.12-17)
第二十一届磁共振脑影像结构班(上海,9.19-24)
第二十四届脑影像机器学习班(上海,10.9-14)
南京:
第六十七届磁共振脑影像基础班(南京,9.15-20)
第五届弥散磁共振成像提高班(南京,9.22-27)
第三十三届磁共振脑网络数据处理班(南京,10.16-21)
第二十二届磁共振脑影像结构班(南京,10.24-29)
北京:
第十一届磁共振ASL(动脉自旋标记)数据处理班(北京,11.3-6)
重庆:
第二十五届脑影像机器学习班(重庆,9.17-22)
第九届脑网络数据处理提高班(重庆,10.13-18)
第七十届磁共振脑影像基础班(重庆,10.22-27)
数据处理业务介绍:
思影科技功能磁共振(fMRI)数据处理业务
思影科技弥散加权成像(DWI/dMRI)数据处理
思影科技脑结构磁共振成像数据处理业务(T1)
思影科技定量磁敏感(QSM)数据处理业务
思影科技啮齿类动物(大小鼠)神经影像数据处理业务
思影科技灵长类动物fMRI分析业务
思影数据处理业务三:ASL数据处理
思影科技脑影像机器学习数据处理业务介绍
招聘及产品:
思影科技招聘数据处理工程师 (上海,北京,南京)
BIOSEMI脑电系统介绍
目镜式功能磁共振刺激系统介绍