探讨慢性皮质下小梗死(chronicsmall subcortical infarct)患者中,相连皮层的皮质层是否受到不同的影响,以及这些差异是否与临床症状相关。
方法:
收集20例慢性皮质下小梗死并影响皮质脊髓束的患者和15名健康对照者。从梗塞灶开始,通过纤维束成像追踪到初级运动皮层。从T1弛豫中计算出T1成分概率图,将皮质分为5个层状高斯类别(laminar gaussian class)。
结果:
与未受影响的对侧皮质相比,局灶性皮质变薄发生在相连的皮质,且仅发生在最深层的层状皮质(p < 0.001)。与对侧未受累脊髓束相比,受累脊髓束的微结构完整性丧失,平均扩散率增加,各向异性分数降低(p≤0.002)。临床评分与皮质脊髓束的微结构损伤和皮质变薄有关,且仅与皮质的最深层有关(p < 0.001)。健康对照组的双侧初级运动皮质的皮层厚度和双侧皮质脊髓束的微观结构完整性没有发现差异。
结论:
结果支持了皮质下小梗死影响与皮质脊髓束相连的初级运动皮层继发性神经变性的概念,最主要的皮质变薄发生在皮质的最深层,且临床症状与这种皮质萎缩模式相关。此发现有助于更好地理解脑卒中后的结构重组和功能结果。(术语表:CADASIL=常染色体显性遗传性脑动脉病伴皮层下梗死和白质脑病;CTS=皮质脊髓束;FA=分数各向异性;IQR=四分位范围;MD=平均扩散率;NIHSSM=美国国立卫生研究院卒中量表运动部分(面部、手臂和腿部无力);NIHSSM-Recovery=MRI扫描时NIHSSM基线与NIHSSM评分的差异;TP-SLF =颞顶上纵束)
皮层下梗死的远端皮层效应对脑卒中后的功能重组有重要作用,并影响临床预后。最近发现,与急性皮层下梗死有远端连接的脑区可有局灶性皮质变薄的改变,而没有连接的脑区未出现远端皮质改变。这些发现是由于连接皮层下纤维束损伤后继发性皮层神经变性所致。
皮层区域的分层方式和厚度不同,区域内的内在连接也不同,不同皮层和皮层下区域之间的宏观连接也不同。这些层具有独特的连接模式,取决于皮层粗细度(Granularity)和它们相连接的区域(下皮层、新皮层等)。越来越多的证据表明,皮层下梗死引起的结构性损伤可能会严重地破坏运动神经网络中枢中兴奋性和抑制性影响的平衡,这种平衡与中风后的临床后遗症和恢复过程有关。
近年来的研究表明,T1弛豫成像具有显示皮层层状结构的能力。在计算得到的全脑T1分量概率图的高斯混合分析的基础上,有可能创建至少5类特异性概率图,以层状模式显示在皮层上。在本研究中,作者通过可视化和量化了5类皮层下梗死影响皮质脊髓束(CST)之后残留运动功能障碍患者的初级运动皮层(M1)的结构效应,验证与连接纤维束的结构改变有关的皮质萎缩影响不同皮质层的假说,并探讨皮质萎缩的程度和模式是否与临床症状相关。该研究由以色列特拉维夫大学学者发表在Neurology杂志。
方法
研究群体
23例(48-78岁)经临床和MRI诊断为慢性(>3个月)首次发作的皮质下小梗死累及CST(如内囊或放射冠的后肢)且有残留的运动缺陷。排除标准包括:
(1)初发后复发性中风;
(2)根据液体衰减反转恢复(FLAIR)图像,白质高信号表现为Fazekas量表评分> 1;
(3)严重的神经系统或非神经系统合并症;
(4)对侧半球相应纤维束内或附近的MRI信号异常;
(5)有任何其他之前存在的结构性脑病变的影像学证据;
(6)有药物依赖性或精神病史。排除3例未发现皮层下梗死累及同侧CST的患者,20名被试有待最后分析。临床评估包括NIH卒中量表(NIHSS)、改良Rankin量表、MRI扫描时Barthel指数和基线NIHSS,即急性发作的时间。为了进一步表征患者的临床运动缺陷,作者提取了NIHSS (NIHSSM:面部、手臂和腿无力,总分0-11分)。此外,通过计算患者在MRI扫描时基线NIHSSM和NIHSSM评分(NIHSSM - recovery)的差异来评估患者的运动恢复情况。还招募了15名年龄相仿的健康对照者,没有神经学、精神病学、心血管或代谢疾病史。
MRI采集参数
使用3TMRI(GE,Milwaukee,WI),8通道相控头线圈。采集方案包括覆盖前额叶皮层的轴位高分辨率多次反转恢复快速自旋回波序列,分辨率0.43×0.43×1.5mm3(矩阵512×384,重建矩阵512×512)。反转时间如下:230、432、575、665、760、920和1080ms。
3DT1结构像:
体素为1mm3的各向同性的T1梯度回波,范围覆盖全脑(TR/TE/IR/FA:9.3ms/3.8ms/450ms/13°)。
DTI参数:
70层(覆盖整个大脑),分辨率2.1×2.1×2.1mm3,重建分辨率为1.58×1.58×2.1mm3(FOV202mm2,采集矩阵96×96,重建矩阵128×128)。扫描参数如下:D/δ为33/26ms,TR为15000ms,TE为87.4ms,b为1000s/mm2,30个梯度方向,包括b0。其他常规MRI序列包括快速自旋回波T2加权图像(TR/TE/层厚/层间距/矩阵/视野:7000ms/90ms/5mm/0.5mm/320×288/24cm2)和FLAIR图像(TR/TE/层厚/层间距/矩阵/FOV/:9000ms/140ms/5mm/0.5mm/288×256/24cm2 ),总扫描时间约为60分钟。
计算T1成分概率图
使用Matlab(MathWorks,Natick,MA)编写的内部代码按照以下公式对反转恢复数据集进行逐个像素拟合M(TIi)/M0= 1−2e(TIi/T1),其中M(TIi)是第i个反转时间的磁化强度,M0是TI为0时的磁化强度。拟合成功后,为每个体素分配一个T1值,从而创建了一个T1值图。通过对全脑T1值进行高斯混合分析并使用贝叶斯指数标准,识别出M1的5个皮质层类别(从最表层到最深层,记为L1-L5)。基于高斯混合分析,可以计算将每个体素分配为每个类别的概率。最终,可以创建类别特定的概率图。因此,每个图像体素都由上述T1类的概率向量表示(图1)。
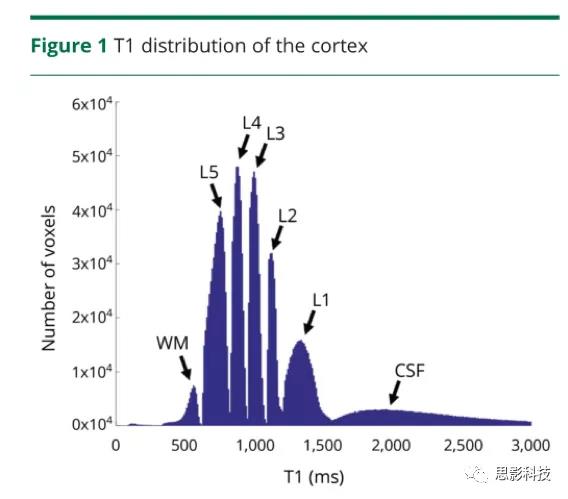
健康对照组的整个皮层T1值的直方图。在直方图中,白质(WM)和脑脊液的峰值分别以560和2000ms为中心,在这两者之间,5个不同的峰值代表了皮层T1 L1-L5层类别。
定义感兴趣区,病灶分割和纤维束追踪
选择皮层下梗死区域为感兴趣区域(ROIs),并由一位受过培训的神经放射学家在FLAIR图像上手动描绘。采用全脑确定性纤维追踪,通过同侧CST(皮质脊髓束)确定同侧M1区域与梗死区域ROI的结构连接。由于弥散张量成像无法正确地追踪90%的白质组织中的交叉纤维,作者使用Explore DTI软件进行了基于约束球面反卷积的纤维束成像。在追踪估计中使用了高到六阶的球面谐波。采用纤维取向分布阈值为0.1,最大角度偏差为30°,步长为1 mm,纤维的最小长度设置为50毫米。提取每个纤维束的平均扩散系数(MD)和分数各向异性(FA)值。同源M1在对侧非受累半球的结构特征是通过相同的方法确定的,即在对侧半球的相应位置放置相同示踪种子点。去除与CST无关的假纤维,以避免与其他束交叉。用2个ROI重建健康对照组的双侧CSTs。第一个ROI放置于内囊的后肢,第二个ROI放置于中央前回。此外,对于脑卒中患者,根据之前所做的标记,基于这些通路的皮层和皮层下连接,采用双种子法重建双侧颞顶上纵束(TP-SLF)(图2)。重建纤维束后,将逐层验证整个轨迹,以确保与已建立的解剖界标一致,并根据需要进行校正。
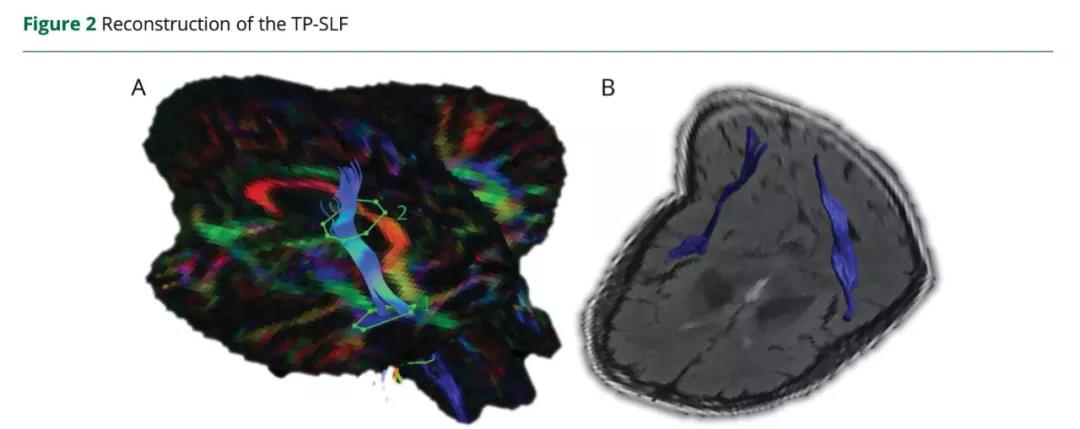
(A)通过”且”操作结合分数各向异性(FA)和方向图,并在轴向水平通过前连合的绿色纤维旁的上升的蓝色纤维上放置第一感兴趣区(ROI)(1),在通过半卵圆中心的纤维上增加第二个ROI(2)。颜色色调指示方向如下:红色,从左到右;绿色,前后;蓝色,上下。亮度与FA成正比。
(B)将FA图与Flair图像进行配准后,显示三维双半球轴面和冠状面上的颞顶顶纵束(TP-SLF)。
皮质厚度测量
使用FreeSurfer(Charlestown,MA)版本5.3.0.26进行皮质表面重建。FreeSurfer已被证明在亚毫米范围内具有较高的有效性和可靠性。在FreeSurfer中,使用多边形网格对单个患者磁共振数据的外部皮质和灰/白质表面进行建模,然后根据表面模型之间指定的对应关系来确定局部皮层厚度值。对受影响的M1 ROI、对侧半球镜像ROI以及连接到TP-SLF的双侧顶叶皮质进行逐像素平均厚度。
纤维束MD和FA特异性分析
扩散张量成像指数(主要是FA,在较小程度上是MD)受体素中纤维总数和纤维堆积密度的影响。MD是一种非特异性指标,尽管它很敏感,但它会受到疾病过程的影响,通常这些疾病过程会影响限制水运动的屏障,比如细胞膜。通常认为MD越低,组织越致密。FA通常被认为是衡量白质完整性的指标,尽管它们的变化可能是由许多因素引起的。使用ExploreDTI获得了源自梗塞的CST(皮质脊髓束)和源自镜像ROI的未受影响的CST以及患者的双侧TP-SLF和健康对照组的双侧CST的平均MD和FA值。我们将受影响和未受影响的CST(DMD,DFA)之间的CST扩散参数差异与相连的M1区域(DM1,DL1-DL5)之间的厚度差异相关联。对双侧CST和健康对照的相连M1进行了相似的分析。
统计分析
分类变量(性别和血管危险因素)用频率和百分比表示。对连续变量行直方图正态分布评估,并使用中位数和四分位范围(IQR)或均值和标准差进行描述。年龄和性别在中风患者和健康对照组之间的人口统计学差异分别用Mann-Whitney检验和Fisher精确检验进行了检验。采用Wilcoxon符号秩检验比较M1皮质层厚度和CST(MD和FA)在患者和健康对照组双侧半球间的扩散参数。用Spearman秩相关系数将病变和非病变CST扩散参数的差异与连接的M1区域的厚度差异联系起来,并探讨这些影像学指标与临床评分之间的关系。敏感性分析通过排除小的皮层下梗死的位置、患者年龄和血管危险因素的影响来验证结果的稳健性。梗死体积与M1皮层厚度相关,与Spearman秩相关系数相关。所有测试均使用IBM SPSS统计软件进行, p< 0.05为差异有统计学意义。如果您对T1结构像分析及DTI数据处理感兴趣,请点击以下文字,可添加微信号siyingyxf或18983979082进行咨询:
第十一届磁共振弥散张量成像数据处理班
第九届磁共振脑影像结构班(南京)
结果
研究被试
表1描述了被试的临床特征。从NIHSS,改良的Rankin量表评分和Barthel指数评分可以看出,MRI扫描时患者变现为轻度残疾。在大多数患者中发现了中风的危险因素。
表1:健康对照组和卒中患者的人口统计学和临床特征
与梗塞相连区域的特定皮层变薄
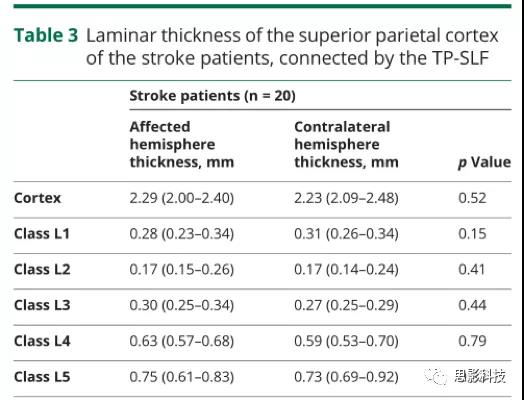
与未受影响的M1相比,受影响的M1的局灶性皮质变薄(表2)。此外,如图3所示,比较所有卒中患者的患病M1和未患病M1时,L5是仅有的病灶变薄的层级(中位数27%,IQR14%–32%)。正如预期的那样,在健康对照的双侧半球之间,M1的总皮质厚度或其单个L1至L5类的厚度没有差异(表2)。为了进一步验证所描述的皮层厚度的差异是否只针对受影响的束和连接的皮层,而不是由于患侧半球的广泛特性,我们从患侧和健侧半球重建了TP-SLF。双侧连接的顶叶皮层的层状模式和总厚度无差异(表3)。
表2健康对照组和卒中患者M1的皮质层厚度。数据以中位数(四分位数范围)表示。p值采用Wilcoxon符号秩检验。受影响的M1通过纤维追踪术检测皮层下小梗死灶和M1之间皮质脊髓束的连接。
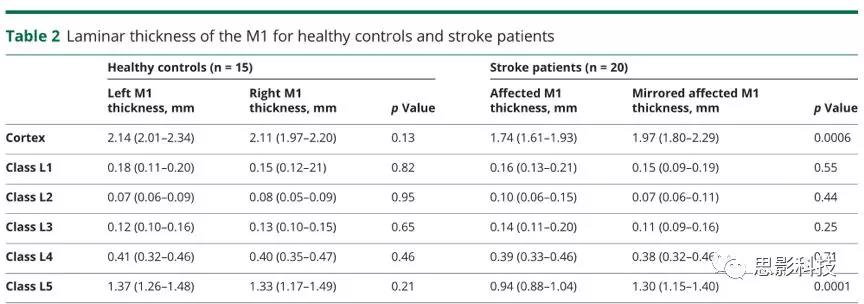
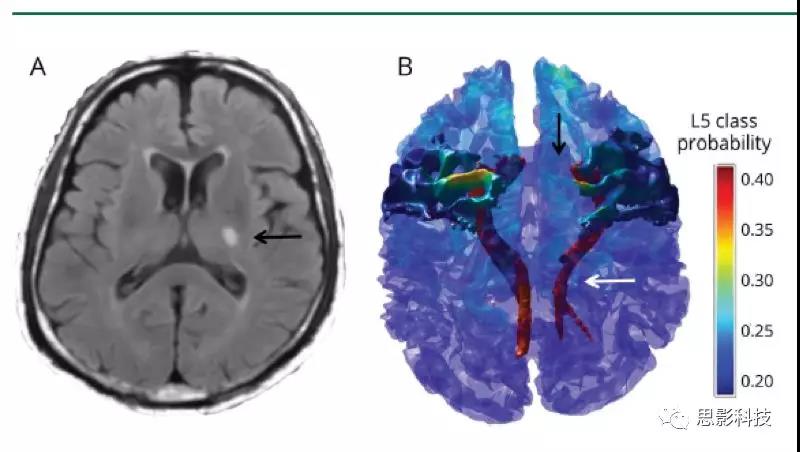
图3皮质下小梗死后CST继发性神经变性及M1连接
(A)左内囊后肢有慢性皮质下小梗死的代表性患者的Flair图像(黑色箭头)。通过使用弥散张量纤维追踪术,选择左内囊后肢梗塞点为种子和手动放置的对照种子来重建皮质脊髓束(CST)并识别相连的M1,如(B)三维体积渲染所示。由此产生的L5类皮层层状模式在三维模型上进行了描述,并将L5的T1层类概率图投影到皮层表面。白色箭头指示梗死上方和下方的左CST变性;黑色箭头指示所连接的左M1的萎缩。
表3由TP-SLF连接的中风患者上顶叶皮质的各层状厚度
连接纤维束的微观结构完整性
与健侧CST相比,患侧的CST中存在扩散异常,这表明MD总体升高
(分别为0.85[0.82-0.90] vs 0.81[0.79-0.83]10-3mm2/s,p=0.002)和FA降低(分别为0.45[0.43-0.46]和0.49[0.47-0.51],p=0.0002)。另一方面,健康对照组双侧CST的扩散参数未见差异(MD 0.77[0.75-0.78] vs0.77[0.76-0.80]10-3mm2/s,p=0.16;FA 0.52[0.49–0.52]与0.50[0.48–0.52],p=0.11)。作为额外的对照,进一步对中风患者的双侧TP-SLF进行了纤维束追踪,并计算了扩散参数。双边TP-SLF之间无差异(MD 0.84[0.80-0.90] vs0.85[0.82-0.88] 10-3mm2/s,p=0.87;FA 0.40[0.39-0.43] vs 0.41[0.38-0.43] ,p=0.63)。
接下来,作者进一步探讨了卒中患者的CST与健侧CST与相连M1之间的关系,并计算了CST扩散参数(ΔMD,ΔFA)的差异与M1厚度模式的差异(ΔM1,ΔL1-DL5)之间的相关性。与健侧CST相比,患侧M1及其L5类的病灶变薄与FA降低相关(ΔM1 vs ΔFAρ= 0.51,p=0.02; DL5 vs ΔFA ρ=0.61,p=0.005),并与增加的MD相关(ΔM1vsΔMD ρ=0.41,p=0.07;ΔL5 vsΔMD ρ=0.44,p=0.05)。L1至L4类之间没有相关性。对于健康对照者,双侧CST的MD和FA的差异与相连M1区域的总或层状厚度(特别是L5)的差异之间没有相关性 (ΔM1与ΔMD ρ= 0.07,p=0.80;ΔL5vsΔMDρ= -0.15,p=0.59;ΔM1vsΔFA ρ= 0.07,p=0.82;ΔL5vsΔFAρ= 0.02,p=0.94)。
与临床评分的关系
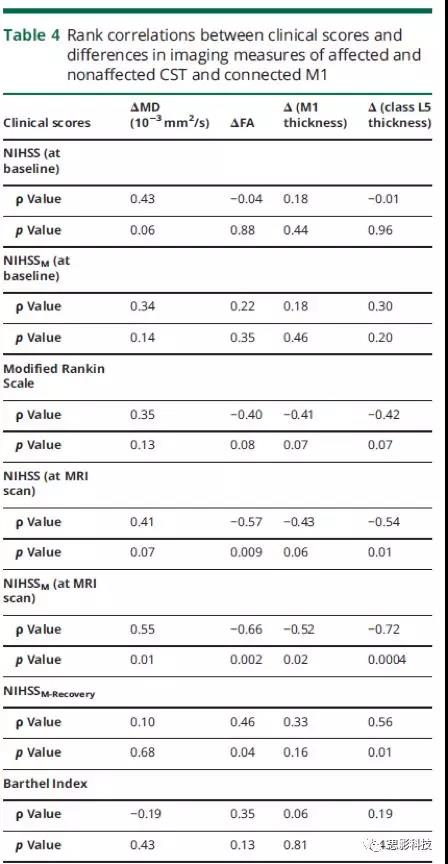
在MRI扫描时,发现M1和L5的厚度差之间以及NIHSSM评分之间存在相关性(表4)。排除梗塞部位的影响以及患者的血管危险因素和年龄对结果没有影响。此外,L5的厚度差异与MRI扫描时的NIHSS评分与NIHSSM-Recovery评分之间也存在相关性(表4)。此外,在MRI扫描时,患侧和健侧CST的FA差异之间以及NIHSSM-Recovery,NIHSS和NIHSSM之间也存在相关性(表4)。MRI扫描时,患侧和健侧CSTs的MD差异也与NIHHSSM评分相关。表4患侧和健侧CST和相连的M1间临床评分与影像学指标差异之间的等级相关性
讨论
作者发现与皮质下小梗死相连的M1变薄,这与先前的研究结果一致,提示相关白质束的主要功能障碍和连接的皮质变薄相关。然而,作者的研究提供的MRI证据表明,大部分皮质萎缩源于L5类的变薄,L5类对应于M1的最深层皮层。
基于体素的形态测量脑卒中后皮质萎缩的体积的研究已有报道,皮质体积的萎缩超过了梗死灶,特别是在同侧半球。最近的一项研究报道了12例上肢麻痹患者在皮层下梗死3个月后皮层灰质的动态变化,作者发现,与缺血性病变相关的脑皮层厚度中值下降2.6%,而与缺血性病变无关的脑皮层厚度基本保持不变。在一项纵向研究中,对9例CADASIL(伴有皮层下梗死和白质脑病的常染色体显性遗传性动脉病)患者偶然发现的皮层下梗死相关区域的皮质变薄进行了34个月的随访,与脑卒中病变相关的皮质区厚度减少了约9%,而与之对应的脑灰质区厚度未见明显变化。在作者的研究中,皮质变薄也是一个重要发现,患侧M1与健侧M1相比,变薄率高达12%。然而,大部分皮质变薄是由L5变薄引起的,平均变薄率为24%。而且,健康对照者的双侧M1和中风患者的双侧上顶叶皮层的皮层厚度和皮层模式均未发现有显着差异。这些发现暗示皮层下卒中后皮层变薄并不像加速衰老那样影响整个大脑,而是结构性连接的大脑特定区域继发性神经变性的结果。选择性神经元缺失影响了组织病理学上远离缺血区但与其有相连的大脑区域。事实上,皮层下小梗死与病变白质束中MD的增加和FA的减少有关。在原发性梗塞远端的下行锥体束中还发现FA值显着降低,并伴有MD增高或未改变。与健侧相比,由于特定的轴突损伤导致的逆行继发性神经退行性变也得到了研究的支持,与健侧相比,患侧CST(皮质脊髓束)丧失了微结构完整性。
使用T1和反转恢复序列来揭示皮质层的结构特征是一种正在发展的方法。尽管人们公认T1可以区分皮层,但皮层与组织学的确切关系以及最有效地提取皮层的最有效采集方案仍在研究中。据观察,从T1概率图中计算出的L1-L5层类似于新皮层6层的组织学性质,可以勾勒出皮质区域之间的一些细胞构造定义的边界,为其生物学意义和相关性提供了有力的证据。因此,作者建议L5代表皮质最深层(包括组织学皮质层V)的组合。在MRI中的观察结果支持了M1细胞结构结构的组织病理学研究,其中M层中的大型锥体神经元(也称为Betz细胞)形成了CST轴突的起源,这些轴突负责自发的运动控制,并穿过内囊,脑干和脊髓。Betz细胞是M1中运动神经元通路的重要组成部分,它们具有收集、整合、翻译和传输兴奋性和抑制性皮质和输入单个信息到远距离脊髓靶标的能力。事实上,在对脑干和胸椎脊髓的皮质脊髓轴突进行逆行标记后,在小鼠中发现V - M1层神经元的密度降低了20%至50%。同样,在脊髓损伤阻断大鼠的运动通路后,运动皮层的V/VI层细胞的脊髓密度降低。其他一些动物研究者发现CST损伤后V层神经元的大小和数量均减少。
本研究显示,在中风患者中,M1和L5的变薄程度存在显著差异(分别为3%-34%和3%-44%),此前的研究并没有报道。因此,作者进一步研究这是否与运动缺陷的变化有关。研究结果证明了连接皮质M1变薄的模式以及MD的增加和FA值的降低,与残留临床症状的严重程度和MRI扫描时的NIHSSM评分之间的相关性。尽管临床评分与受影响和未受影响的CST的影像学指标间差异的等级相关性并不暗示因果关系,但这些发现进一步支持了具有选择性神经丢失和继发性神经变性的皮层病理在皮层下小梗死患者临床运动症状表达中的作用。L5变薄与急性发作时的基线NIHSS / NIHSSM评分并不相关,但与NIHSSM-Recovery评分呈负相关(表4),因此皮质萎缩的程度更能反映出运动恢复的程度,并且受神经活动程度的影响较小。在皮层变薄模式与Barthel指数、改良的Rankin量表或基线NIHSS / NIHSSM评分之间未发现关联。Barthel指数和改良的Rankin量表可测量卒中后的残疾和依赖性,因此,与NIHSS / NIHSSM相比,它们具有相关性,但在评估涉及CST的皮质下小梗死后神经系统运动功能障碍的特异性较低。此外,经证实Barthel指数在评估轻度中风患者中与中风相关的残疾效果有限。
本研究局限于对慢性期患者MRI检查而非急性期患者的影像学分析。在急性发作中很难实施磁共振检查方案,主要是因为急性期短(约1小时)以及中风患者很难在急性中风时配合检查。在健康对照组与卒中患者的比较中发现,患者中观察到的患侧M1皮质变薄的确是由受影响的CST继发性神经变性导致的。本研究显示,在明确定义的一组患者中,将白质束成像与T1弛豫成像和基于表面的皮层厚度分析相结合,可发现对皮质层的层状萎缩模式的直接影响。患侧相连的M1变薄,这主要是由于L5类的变薄所致,大概是组织学皮层V,即受影响侧的CST起源。随着运动功能障碍越来越严重,M1和L5类的变薄以及CST的微结构损伤会增加。这种皮层退化与症状的关系表明,皮质神经退行性变是了解皮质下小梗死卒中患者临床异质性神经基础的关键组成部分,因此有助于设计假设驱动的治疗策略,以促进运动功能的恢复。
总结:
本研究结合基于弥散成像的确定性纤维束追踪技术和基于T1像的皮层分割技术,探究了皮质下梗死患者的皮层结构性变化以及与运动功能障碍的关系;此外本文使用的皮层分层T1成分概率图的方法可以对皮层进行进一步划分,同样值得借鉴。如需
原文请加微信:siyingyxf 或者18983979082获取,如对思影课程感兴趣也可加此微信号咨询。

微信扫码或者长按选择识别关注思影
非常感谢转发支持与推荐
欢迎浏览思影的数据处理课程以及数据处理业务介绍。(请直接点击下文文字即可浏览思影科技其他课程,欢迎报名与咨询):
第九届磁共振脑影像结构班(南京)
第六届任务态fMRI专题班(重庆)
第十四届磁共振脑网络数据处理班(重庆)
第十九届脑电数据处理中级班(南京)
第十八届脑电数据处理中级班(南京)
招聘:脑影像数据处理工程师(重庆&南京)